Cellules souches embryonnaires : on sait les fabriquer génétiquement !
Coup sur coup, deux équipes sont parvenues à transformer des cellules adultes en cellules souches capables de donner naissance à tous les tissus et organes du corps humain. Et une troisième a, par cette même technique, réussi à guérir des souris. Un bond vers la thérapie cellulaire ?
Lise Barnéoud - Publié le
Une cure de jouvence cellulaire
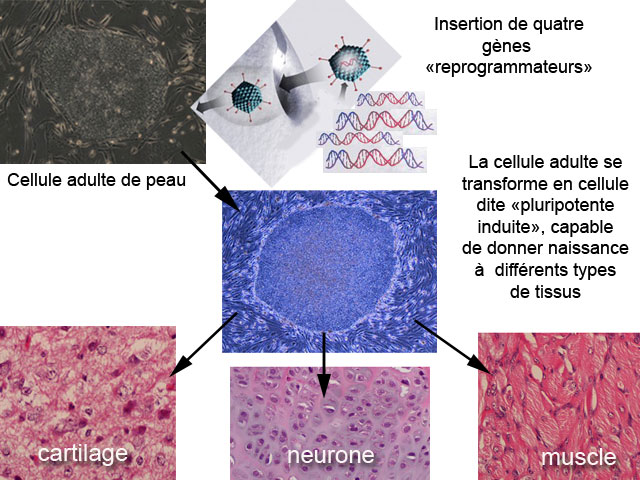
Prélevez des cellules adultes, issues de la peau par exemple. Insérez dans leur noyau quatre gènes qui ne s'expriment normalement qu'au stade embryonnaire. Patientez quelques semaines. Vous obtenez des cellules capables de donner naissance à tous les tissus et organes du corps humain. Vous pouvez alors greffer ces nouveaux tissus sur le patient-donneur sans aucun risque de rejet.
Cela ressemble à de la science fiction. C'est pourtant en suivant cette recette que deux équipes de chercheurs - l'une menée par Shinya Yamanaka de l'Université de Kyoto et l'autre dirigée par James Thomson de l'Université de Wisconsin - sont parvenues pour la première fois à « reprogrammer » des cellules adultes humaines en cellules possédant des propriétés similaires à celles des cellules souches embryonnaires (Cell, 30 novembre 2007 ; Science, édition en ligne, 20 novembre 2007)
 « On peut revenir en arrière à condition de taper très fort sur la cellule » Marc Peschanski, directeur de l’Institut des cellules souches (I-Stem) © Science Actualités (CSI) 2007Ces cellules, dites « pluripotentes induites » (CPi ou iPS en anglais pour induced pluripotent stem), ont ensuite été orientées in vitro vers différents types cellulaires, notamment des cellules musculaires cardiaques qui se sont mises à battre au bout de douze jours dans le tube à essai… Un exploit salué par la plupart des experts, qui n'hésitent pas à parler d'une véritable « révolution scientifiques ».
« On peut revenir en arrière à condition de taper très fort sur la cellule » Marc Peschanski, directeur de l’Institut des cellules souches (I-Stem) © Science Actualités (CSI) 2007Ces cellules, dites « pluripotentes induites » (CPi ou iPS en anglais pour induced pluripotent stem), ont ensuite été orientées in vitro vers différents types cellulaires, notamment des cellules musculaires cardiaques qui se sont mises à battre au bout de douze jours dans le tube à essai… Un exploit salué par la plupart des experts, qui n'hésitent pas à parler d'une véritable « révolution scientifiques ».
Une recette relativement simple
« On ne pensait pas que ce serait si facile, a déclaré James Thomson lors de la présentation de ses travaux. Des milliers de laboratoires aux États-Unis pourraient le faire demain ». Encore faut-il maîtriser quelques techniques de manipulation génétique.
Du côté des Américains, les chercheurs ont prélevé des cellules issues de la peau d'un fœtus et du prépuce d'un nouveau-né. Puis ils y ont inséré quatre gènes (Oct3/4, Sox2, LIN28 et NANOG) au moyen d'un vecteur viral (rétrovirus). Ces gènes ont été choisis car ils s'expriment lors des premières phases du développement embryonnaire et semblent ne jamais s'exprimer ensemble par la suite.
Les Japonais quant à eux ont récupéré des cellules de peau et de tissu conjonctif chez une femme de 36 ans et un homme de 69 ans et un autre cocktail de gènes spécifiques aux cellules embryonnaires a été inséré (Oct3/4, Sox2 également et Klf4). A ces trois gènes, ils en ont ajouté un autre (c-Myc) qui ne s'exprime que dans les cellules cancéreuses. Ils l'ont utilisé pour forcer la prolifération cellulaire.
Grâce aux rétrovirus, ces gènes vont intégrer le génome des cellules adultes et activer plusieurs centaines d'autres gènes qui vont enclencher une sorte de « déspécialisation », de retour en arrière en quelque sorte. Les cellules ainsi manipulées génétiquement deviennent alors capables, commes les cellules souches embryonnaires, de se différentier en plus de 200 types cellulaires (peau, muscle, neurone…).
Un pas de plus vers la « médecine régénératrice »
Dans la droite ligne de ces travaux, une troisième équipe a eu recours à la même recette, en la combinant cette fois avec une technique de thérapie génique*, pour tenter de guérir des souris atteintes de drépanocytose, une maladie sanguine due à un défaut de structure de l'hémoglobine et responsable notamment de graves anémies. Résultat : l'injection des cellules "pluripotentes induites" - qui ont reçu les quatre gènes reprogrammateurs et une copie dans le sang des souris leur permet de produire des glogules rouges normaux et diminue les symptômes de la maladie. Cette dernière publication (Science, 7 décembre 2007) ainsi que les précédents travaux prouvent désormais que la technique est réalisable chez l'homme.
*En plus des quatre gènes nécessaires à la reprogrammation des cellules adultes en cellules souches, le gène "normal" de l'hémoglobine a également été introduit pour corriger le gène défaillant.
La course aux cellules souches embryonnaires
Lorsque les premières cellules souches embryonnaires humaines ont été obtenues en 1998, les scientifiques se sont enthousiasmés devant ces cellules immortelles, capables de se différencier en n'importe quels tissus et organes du corps humain (ce qui n'est pas le cas des autres cellules souches). Leurs propriétés laissaient alors entrevoir une nouvelle façon de se soigner : il suffirait de maîtriser in vitro leur développement pour créer une banque de tous les tissus du corps humain et s'en servir à chaque fois qu'un organe tomberait en panne. Bref, l'espoir d'une « médecine régénératrice » était né. Mais comment obtenir des cellules souches embryonnaires dont le patrimoine génétique serait en tous points identique à celui d'un patient ? La plupart des scientifiques qui travaillent sur ces cellules le font soit à partir de lignées existantes soit à partir d'embryons surnuméraires issus des centres de fécondation in vitro. Or, si ce matériel a incontestablement permis de grandes avancées scientifiques, il ne peut être utilisé en thérapie cellulaire sans risque de rejet. Il fallait donc trouver une autre solution.
Première option : le clonage. L'idée est de prélever le noyau d'une cellule du patient, de l'insérer dans un ovule préalablement énucléé, puis de faire se développer l'embryon jusqu'au stade blastocyste (5-7 jours) pour en prélever les cellules souches. Problème : personne ne maîtrise encore cette technique chez l'homme, elle nécessite un nombre incalculable d'ovocytes chez l'animal et elle soulève un certain nombre de questions au plan éthique (bien que conçu artificiellement, un embryon est finalement détruit). Par ailleurs, ce clonage dit « thérapeutique » pourrait ouvrir la porte au clonage reproductif humain, qui, bien que rejeté par l'ensemble de la communauté scientifique, n'est toujours pas interdit par voie légale à l'échelle mondiale.
C'est alors que certains scientifiques ont eu l'idée d'essayer de transformer génétiquement une cellule adulte pour lui donner toutes les caractéristiques d'une cellule souche embryonnaire. Il suffirait en quelque sorte de percer le secret des cellules souches embryonnaires pour tenter de « rajeunir » les cellules adultes et les transformer en cellules pluripotentes, sans passer par la « case embryon ». En 2006, après des années de recherche, l'équipe menée par le professeur Yamanaka parvient à identifier quatre gènes impliqués dans ce processus et à les insérer dans des cellules adultes de souris. Résultat : les cellules deviennent effectivement pluripotentes tout comme les cellules souches embryonnaires. Il venait ainsi d'ouvrir la voie à cette option dite de « reprogrammation », qui possède l'avantage de se passer d'embryons et d'ovules.
Encore beaucoup d'incertitudes
 Marc Peschanski : « On a la crainte que ces cellules ne cessent de proliférer une fois transplantées » © Science Actualités (CSI) 2007
Marc Peschanski : « On a la crainte que ces cellules ne cessent de proliférer une fois transplantées » © Science Actualités (CSI) 2007
Mais la route est encore longue vers cette médecine du futur dite régénératrice. Si les cellules « pluripotentes induites » sont effectivement capables de se transformer en tissus fonctionnels in vitro, rien ne prouve qu'une fois transplantées elles parviendront à remplacer efficacement l'organe déficient. Surtout, on ne sait pas comment évolueront ces cellules modifiées génétiquement. Les recherches sur les souris ont en effet montré que cette manipulation génétique entraînait des tumeurs. Logique, puisque parmi les « gènes reprogrammateurs » certains sont cancérigènes et sont justement utilisés pour forcer la prolifération cellulaire. Par ailleurs, les virus utilisés pour insérer ces gènes dans le génome de la cellule adulte représente également un risque de cancers.
« Ces résultats vont sans aucun doute accélérer la recherche vers la thérapie cellulaire, a déclaré James Thomson à l'issue de sa publication. Mais d'autres travaux sont nécessaires avant d'envisager une quelconque application ».
Quid du clonage thérapeutique
Certains voient dans ces deux publications la fin du clonage thérapeutique. Le biologiste écossais Ian Wilmut, qui avait cloné le premier mammifère en 1997, a même décidé d'abandonner la technique du transfert nucléaire pour se consacrer à la reprogrammation, plus simple et plus réalisable à ses yeux. Selon John Gearhart, directeur du programme de recherche sur les cellules souches à l'Université de Johns Hopkins (Baltimore, Etats-Unis) « si la stratégie de la reprogrammation s'avère efficace – ce qui devrait être démontré très prochainement – cela diminuera le rôle du transfert nucléaire pour obtenir des cellules pluripotentes dont le patrimoine génétique est identique aux patients ».
Des raisonnements absurdes, selon Shoukrat Mitalipov de l'Université d'Orégon qui vient justement de parvenir à cloner des embryons de macaques : « La façon la plus naturelle de reprogrammer des cellules adultes en cellules souches embryonnaires est d'utiliser les ovules ! Par cette méthode, vous n'avez besoin d'aucune manipulation génétique, d'aucun gène susceptible d'entraîner des cancers, d'aucun virus… Le problème, c'est que personne n'a encore réussi cette technique chez l'homme et qu'elle paraît encore très compliquée. Il faut beaucoup d'ovules et il y a peu d'aides financières à cause des questions éthiques que ces recherches soulèvent. Voilà pourquoi certains chercheurs abandonnent cette voie ».
Pour Shinya Yamanaka, il serait également « prématuré de conclure que les cellules pluripotentes induites remplaceront les cellules souches embryonnaires ». Une analyse de près de 30 000 gènes a ainsi révélé que ces cellules reprogrammées n'étaient pas identiques aux cellules souches embryonnaires. Un millier de gènes s'exprimeraient différemment. On ignore, par exemple, si ces différences jouent sur les capacités de division à long terme des cellules.
Au-delà de la médecine régénératrice...
Si la piste de la thérapie cellulaire est toujours mise en avant, elle ne représente pas l'unique intérêt de ces cellules embryonnaires. En terme de recherche fondamentale, ces cellules permettent notamment de percer un peu plus les secrets du développement embryonnaire et du fonctionnement cellulaire. On commence ainsi à comprendre quels mécanismes moléculaires sont impliqués dans l'immortalité de ces cellules.
 Marc Peschanski ; « La modélisation de maladies au travers de ces cellules représente un intérêt majeur » © Science Actualités (CSI) 2007
Marc Peschanski ; « La modélisation de maladies au travers de ces cellules représente un intérêt majeur » © Science Actualités (CSI) 2007Mais l'intérêt le plus exploité aujourd'hui des cellules embryonnaires est de s'en servir comme modèles pour étudier certaines maladies. De nombreux laboratoires travaillent effectivement sur des cellules issues d'embryons porteur d'une pathologie décelée lors d'un diagnostic préimplantatoire. Cela permet alors d'observer, dans un tube à essai, le développement de ces maladies au niveau cellulaire.
« On pourrait ainsi tester presque en aveugle toutes les molécules qu'on possède et qui pourrait avoir un effet bénéfique, histoire de trouver par hasard, comme cela est déjà arrivé à de nombreuses reprises par le passé, de nouveaux médicaments », explique Marc Peschanski, directeur de l'Institut des cellules souches (I-Stem). Les traitements pharmacologiques ont encore de beaux jours devant eux…

