CRISPR-Cas9 : le couteau suisse qui révolutionne la génétique
Alors que des chercheurs viennent de parvenir à corriger des gènes défectueux chez l'embryon humain, retour sur ce nouvel outil génétique qui se répand comme une traînée de poudre dans les laboratoires du monde entier. Son principal atout : une facilité d'utilisation déconcertante qui démocratise l'étude des gènes.
Jean-Philippe Braly - Publié le
 Six millions de dollars. À lui seul, ce chiffre résume l’engouement actuel pour un nouvel outil de génie génétique aussi puissant qu’imprononçable : « CRISPR-Cas9 ». Cette somme a en effet été décernée à ses deux co-inventrices – la Française Emmanuelle Charpentier et l’Américaine Jennifer Doudna – par le prestigieux Prix « Breakthrough 2015 in Life Sciences » créé par les fondateurs de Google et Facebook. Il faut dire que CRISPR-Cas9 constitue une véritable révolution en mettant le génie génétique à la portée de n’importe quel laboratoire... À la clef, l’espoir de traiter de nombreuses maladies génétiques incurables. Et l’enthousiasme est palpable dans le milieu médical : pour Alain Fischer, grand spécialiste français de thérapie génique, cet outil pourrait même valoir le prix Nobel au duo Charpentier-Doudna ! Voici l’histoire d’une incroyable épopée scientifique initiée il y a près de trente ans par des recherches très fondamentales au Japon...
Six millions de dollars. À lui seul, ce chiffre résume l’engouement actuel pour un nouvel outil de génie génétique aussi puissant qu’imprononçable : « CRISPR-Cas9 ». Cette somme a en effet été décernée à ses deux co-inventrices – la Française Emmanuelle Charpentier et l’Américaine Jennifer Doudna – par le prestigieux Prix « Breakthrough 2015 in Life Sciences » créé par les fondateurs de Google et Facebook. Il faut dire que CRISPR-Cas9 constitue une véritable révolution en mettant le génie génétique à la portée de n’importe quel laboratoire... À la clef, l’espoir de traiter de nombreuses maladies génétiques incurables. Et l’enthousiasme est palpable dans le milieu médical : pour Alain Fischer, grand spécialiste français de thérapie génique, cet outil pourrait même valoir le prix Nobel au duo Charpentier-Doudna ! Voici l’histoire d’une incroyable épopée scientifique initiée il y a près de trente ans par des recherches très fondamentales au Japon...
Palindrome d'ADN
Retour en 1987. Dans un laboratoire de l’université d’Osaka, le biologiste Atsuo Nakata découvre de bien curieuses séquences d’ADN répétitives dans le génome de bactéries Escherichia coli. Dans certaines parties de ces séquences, les quatre lettres constitutives de l’ADN – adénine (A), guanine (G), cytosine (C) et thymine (T) – forment des suites immédiatement suivies des mêmes suites en sens inverse : elles peuvent donc se lire dans les deux sens, formant ainsi des palindromes. Mais ne semblant servir à rien de précis, ces énigmatiques séquences n’intéressent pas grand monde. Ce n’est d’ailleurs qu’en 2002 que des scientifiques daigneront leur donner un nom officiel : CRISPR pour Clustered Regularly Interspaced Palindromic Repeats, reflétant leur étrange conformation au rôle encore inconnu. 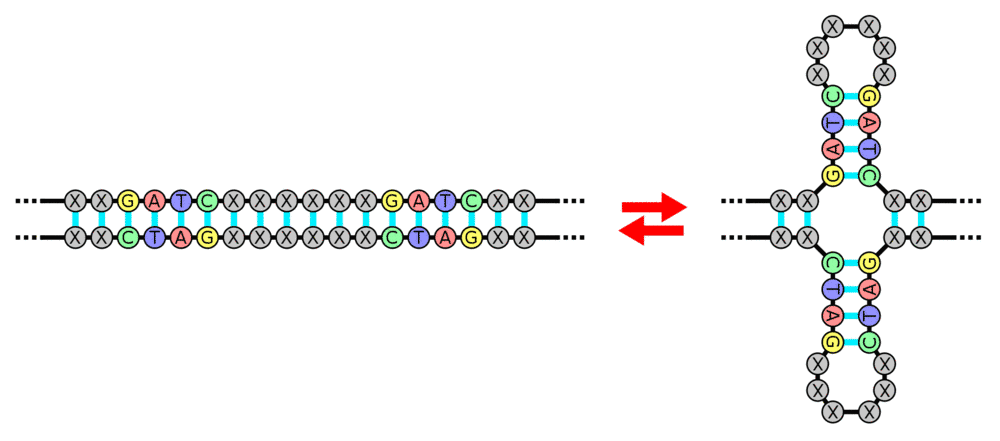 Trois ans plus tard, les choses s’accélèrent. En effet, des bioinformaticiens découvrent que les morceaux d’ADN intercalés entre ces palindromes sont souvent des morceaux d’ADN de virus capables d’infecter les bactéries (bactériophages)… En 2007, des chercheurs de l’entreprise agroalimentaire danoise Danisco découvrent que, parmi les bactéries Streptococcus thermophiles qu’ils utilisent pour fabriquer des yaourts et des fromages, celles qui ont des séquences CRISPR survivent mieux aux infections par ce type de virus. Tout se passe donc comme si ces bactéries archivaient, dans leurs séquences CRISPR, l’ADN des virus les ayant préalablement infectés, puis s’en servaient ensuite pour repérer ces virus et les combattre. Un mécanisme qui rappelle étrangement celui de la vaccination...
Trois ans plus tard, les choses s’accélèrent. En effet, des bioinformaticiens découvrent que les morceaux d’ADN intercalés entre ces palindromes sont souvent des morceaux d’ADN de virus capables d’infecter les bactéries (bactériophages)… En 2007, des chercheurs de l’entreprise agroalimentaire danoise Danisco découvrent que, parmi les bactéries Streptococcus thermophiles qu’ils utilisent pour fabriquer des yaourts et des fromages, celles qui ont des séquences CRISPR survivent mieux aux infections par ce type de virus. Tout se passe donc comme si ces bactéries archivaient, dans leurs séquences CRISPR, l’ADN des virus les ayant préalablement infectés, puis s’en servaient ensuite pour repérer ces virus et les combattre. Un mécanisme qui rappelle étrangement celui de la vaccination...
Duo féminin franco-américain
C’est là qu’entrent en scène l’Américaine Jennifer Doudna de l’université californienne Berkeley, et la microbiologiste française Emmanuelle Charpentier qui travaille alors à l’université suédoise d’Umeå. Ensemble, ces équipes décryptent l’un des principaux mécanismes en jeu. Pour résumer, elles découvrent que les ADN viraux des séquences CRISPR sont recopiés en plus petites molécules nommées ARN qui s’attellent à une enzyme nommée Cas9. Ensuite, dans la bactérie, si un ARN de ce type croise un virus à l’ADN correspondant, il s’apparie à cet ADN. Enfin, une fois l’appariement effectué, la Cas9 élimine le virus en découpant les deux brins de son ADN. Le système CRISPR-Cas9 constitue donc un redoutable attelage pour détecter une séquence d’ADN particulière, puis la découper avec précision… le tout selon un mécanisme relativement simple. Autant de caractéristiques qui attisent la curiosité des experts en génie génétique… L’idée ? Concevoir en laboratoire un ARN guide correspondant à tel ou tel gène que l’on souhaite cibler, puis l’arrimer à une enzyme Cas9 pour qu’elle aille le découper ; les chercheurs pourraient ainsi établir la fonction de ce gène, ou bien encore supprimer un gène néfaste ou déficient. C’est précisément ce que les équipes de Charpentier et Doudna réussissent à faire en 2012. 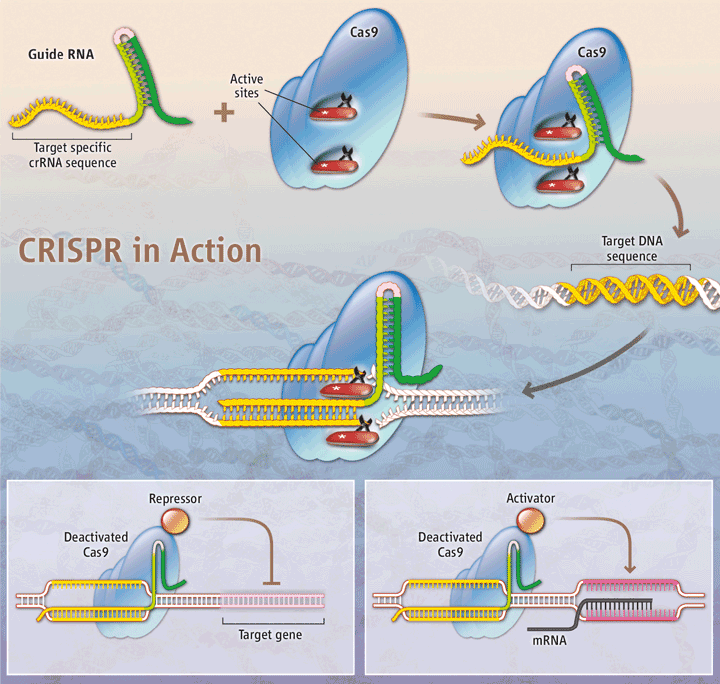 Publié dans la revue Science, ce résultat fait immédiatement boule de neige aux quatre coins du monde. Le bal démarre en janvier 2013, lorsque quatre équipes réussissent à détruire des gènes cibles dans des cellules humaines. Les applications s'enchaînent ensuite avec succès, à un rythme effréné, pour modifier des gènes d’organismes aussi divers que variés : bactéries, levures, riz, mouches, nématodes, poissons-zèbres, rongeurs, etc. « De plus en plus de laboratoires sont aujourd’hui convaincus de l’efficacité du système CRISPR-Cas, confirme Christine Pourcel, microbiologiste à l’Institut de génétique et microbiologie d’Orsay, un laboratoire qui a également beaucoup contribué aux connaissances sur les CRISPRs. Il est appliqué à toutes sortes de cellules et d’organismes et des modifications de la technique originale sont publiées. » En effet, certains chercheurs sont parvenus à modifier légèrement la technique pour que la Cas9 ne coupe pas le gène cible, mais stimule son expression, l’inhibe ou le remplace par un autre… transformant l’outil en une sorte de « couteau suisse génétique » ! Un succès tel que la revue Science n’aura d’autre choix que de faire figurer CRISPR-Cas9 dans son palmarès des plus grandes percées scientifiques de l’année 2013. Mais CRISPR-Cas9 était bien loin d’avoir dit son dernier mot.
Publié dans la revue Science, ce résultat fait immédiatement boule de neige aux quatre coins du monde. Le bal démarre en janvier 2013, lorsque quatre équipes réussissent à détruire des gènes cibles dans des cellules humaines. Les applications s'enchaînent ensuite avec succès, à un rythme effréné, pour modifier des gènes d’organismes aussi divers que variés : bactéries, levures, riz, mouches, nématodes, poissons-zèbres, rongeurs, etc. « De plus en plus de laboratoires sont aujourd’hui convaincus de l’efficacité du système CRISPR-Cas, confirme Christine Pourcel, microbiologiste à l’Institut de génétique et microbiologie d’Orsay, un laboratoire qui a également beaucoup contribué aux connaissances sur les CRISPRs. Il est appliqué à toutes sortes de cellules et d’organismes et des modifications de la technique originale sont publiées. » En effet, certains chercheurs sont parvenus à modifier légèrement la technique pour que la Cas9 ne coupe pas le gène cible, mais stimule son expression, l’inhibe ou le remplace par un autre… transformant l’outil en une sorte de « couteau suisse génétique » ! Un succès tel que la revue Science n’aura d’autre choix que de faire figurer CRISPR-Cas9 dans son palmarès des plus grandes percées scientifiques de l’année 2013. Mais CRISPR-Cas9 était bien loin d’avoir dit son dernier mot.
Premiers résultats encourageants sur des maladies génétiques
 Février 2014, université médicale de Nanjing. Dans des embryons de macaques asiatiques encore constitués d’une seule cellule, Jiahao Sha et ses collègues injectent des ARN guides ciblant trois gènes particuliers, et le matériel nécessaire à la synthèse de la Cas9. Premier résultat : chez huit embryons ainsi traités, CRISPR-Cas9 avait correctement agi sur deux des trois gènes. Transférés dans une femelle porteuse, des embryons ont donné naissance à des jumeaux : ils possédaient toujours les deux gènes cibles modifiés par CRISPR-Cas9 sans mutation sur le reste du génome. Un mois plus tard, une autre équipe – emmenée par Tyler Jacks et Daniel Anderson du Massachusetts Institute of Technology – utilise CRISPR-Cas9 pour corriger une maladie génétique incurable du foie : la « tyrosinémie » causée par une mutation génétique sur un gène nécessaire pour dégrader l’acide aminé nommé tyrosine. Résultat : chez des souris souffrant de cette pathologie, CRISPR-Cas9 a réussi à remplacer le gène déficient par sa forme saine dans environ 0,5 % des cellules du foie (hépatocytes). Au bout d’un mois, ces cellules redevenues saines avaient proliféré : elles représentaient un tiers de tous les hépatocytes... de quoi permettre aux souris de survivre sans le traitement de référence ! À l’été 2014, c’est à une autre maladie génétique incurable que s'attaquent les chercheurs : la « myopathie de Duchenne », une dégénérescence musculaire due à des mutations sur le gène codant pour la protéine indispensable au bon fonctionnement des fibres musculaires. À l’université du Texas, des chercheurs parviennent à corriger cette mutation dans des embryons de souris, puis les réimplantent dans des mères porteuses. Neuf mois après leur naissance, parmi ceux chez lesquels la correction avait touché au moins 40 % des cellules, les muscles étaient parfaitement normaux !
Février 2014, université médicale de Nanjing. Dans des embryons de macaques asiatiques encore constitués d’une seule cellule, Jiahao Sha et ses collègues injectent des ARN guides ciblant trois gènes particuliers, et le matériel nécessaire à la synthèse de la Cas9. Premier résultat : chez huit embryons ainsi traités, CRISPR-Cas9 avait correctement agi sur deux des trois gènes. Transférés dans une femelle porteuse, des embryons ont donné naissance à des jumeaux : ils possédaient toujours les deux gènes cibles modifiés par CRISPR-Cas9 sans mutation sur le reste du génome. Un mois plus tard, une autre équipe – emmenée par Tyler Jacks et Daniel Anderson du Massachusetts Institute of Technology – utilise CRISPR-Cas9 pour corriger une maladie génétique incurable du foie : la « tyrosinémie » causée par une mutation génétique sur un gène nécessaire pour dégrader l’acide aminé nommé tyrosine. Résultat : chez des souris souffrant de cette pathologie, CRISPR-Cas9 a réussi à remplacer le gène déficient par sa forme saine dans environ 0,5 % des cellules du foie (hépatocytes). Au bout d’un mois, ces cellules redevenues saines avaient proliféré : elles représentaient un tiers de tous les hépatocytes... de quoi permettre aux souris de survivre sans le traitement de référence ! À l’été 2014, c’est à une autre maladie génétique incurable que s'attaquent les chercheurs : la « myopathie de Duchenne », une dégénérescence musculaire due à des mutations sur le gène codant pour la protéine indispensable au bon fonctionnement des fibres musculaires. À l’université du Texas, des chercheurs parviennent à corriger cette mutation dans des embryons de souris, puis les réimplantent dans des mères porteuses. Neuf mois après leur naissance, parmi ceux chez lesquels la correction avait touché au moins 40 % des cellules, les muscles étaient parfaitement normaux !
Vers un bébé CRISPR ?
Mais la puissance de l’outil commence à susciter des inquiétudes. En avril 2015, une équipe chinoise s’est en effet servie de CRISPR-Cas9 pour tenter de modifier le génome d’un embryon... humain ! Première mondiale, cette modification du patrimoine héréditaire de l’espèce humaine contrevient à la convention d’Oviedo ratifiée par la France et 28 autres pays européens en 2011. Car, même s’il s’agit comme ici de prévenir le développement d’une maladie génétique, modifier le génome d’un embryon humain, c’est aussi modifier celui de ses futures cellules sexuelles... et donc de toute sa descendance potentielle. Bref, la porte ouverte à l’eugénisme.  Mais très concrètement, en quoi a consisté cette étude chinoise ? Tout d’abord, le généticien Junjiu Huang et ses collègues de l’université Sun-Yat-sen de Canton ont récupéré dans des centres de fécondation in vitro quelque 80 embryons qui présentaient des chromosomes surnuméraires : ils n’auraient pas été viables. L’objectif n’était donc pas de les réimplanter à des femmes, mais de tester l’efficacité de CRISPR-Cas9 pour corriger le gène responsable d’une maladie génétique du sang : la bêta-thalassémie. Le résultat a été mitigé puisque de nombreux embryons présentaient à la fois des cellules où l’ADN avait bien été corrigé et d’autres où il ne l’avait pas été ; les experts parlent de « structure mosaïque ». Mais la technologie CRISPR-Cas9 fait l’objet d’améliorations permanentes... « On peut se demander si ces travaux chinois sur la modification d’embryons humains ne pourraient pas conduire bientôt à la naissance d’un “bébé CRISPR”, il semble en tout cas que plusieurs équipes chinoises travaillent aujourd’hui sur ce thème, s’inquiète ainsi Christine Pourcel. Il serait intéressant de consacrer une analyse aux problèmes d’éthiques soulevés par ces avancées, alors que certains rêvent d’éradiquer les défauts génétiques héréditaires et donc de permettre à des personnes porteuses de mutations d’avoir des enfants sains. » Elle n’est pas la seule à s’inquiéter. Des chercheurs américains ont publié des mises en garde sur l’utilisation de CRISPR-Cas9 pour modifier les cellules germinales dans les revues Science et Nature. Pour Tuan Huy Nguyen, généticien Inserm au Centre de recherche en transplantation et immunologie de Nantes, « ce type d’expérience ouvre un grand débat sur la manipulation génétique de l’embryon humain à des fins d’amélioration de l’espèce, ce qui est interdit avec raison... même si l’objet de l’article a été de corriger une mutation génétique responsable d’une maladie ». Également interrogée sur cette publication, Emmanuelle Charpentier confirme rapidement : « Elle n’a pas été approuvée par la communauté scientifique ».
Mais très concrètement, en quoi a consisté cette étude chinoise ? Tout d’abord, le généticien Junjiu Huang et ses collègues de l’université Sun-Yat-sen de Canton ont récupéré dans des centres de fécondation in vitro quelque 80 embryons qui présentaient des chromosomes surnuméraires : ils n’auraient pas été viables. L’objectif n’était donc pas de les réimplanter à des femmes, mais de tester l’efficacité de CRISPR-Cas9 pour corriger le gène responsable d’une maladie génétique du sang : la bêta-thalassémie. Le résultat a été mitigé puisque de nombreux embryons présentaient à la fois des cellules où l’ADN avait bien été corrigé et d’autres où il ne l’avait pas été ; les experts parlent de « structure mosaïque ». Mais la technologie CRISPR-Cas9 fait l’objet d’améliorations permanentes... « On peut se demander si ces travaux chinois sur la modification d’embryons humains ne pourraient pas conduire bientôt à la naissance d’un “bébé CRISPR”, il semble en tout cas que plusieurs équipes chinoises travaillent aujourd’hui sur ce thème, s’inquiète ainsi Christine Pourcel. Il serait intéressant de consacrer une analyse aux problèmes d’éthiques soulevés par ces avancées, alors que certains rêvent d’éradiquer les défauts génétiques héréditaires et donc de permettre à des personnes porteuses de mutations d’avoir des enfants sains. » Elle n’est pas la seule à s’inquiéter. Des chercheurs américains ont publié des mises en garde sur l’utilisation de CRISPR-Cas9 pour modifier les cellules germinales dans les revues Science et Nature. Pour Tuan Huy Nguyen, généticien Inserm au Centre de recherche en transplantation et immunologie de Nantes, « ce type d’expérience ouvre un grand débat sur la manipulation génétique de l’embryon humain à des fins d’amélioration de l’espèce, ce qui est interdit avec raison... même si l’objet de l’article a été de corriger une mutation génétique responsable d’une maladie ». Également interrogée sur cette publication, Emmanuelle Charpentier confirme rapidement : « Elle n’a pas été approuvée par la communauté scientifique ».
Enjeux économiques
Mais ces risques de dérives ne semblent pas freiner l’enthousiasme pour cet outil révolutionnaire qui aiguise bien des appétits... financiers. Les sociétés du secteur des biotechs ne jurent plus que par CRISPR-Cas9 tandis que celles qui avaient misé sur des technologies concurrentes, plus chères et plus complexes, accusent le coup ! Quant aux deux inventrices de cette technique, elles ont chacune fondé des sociétés – CRISPR Therapeutics pour Emmanuelle Charpentier et Editas pour Jennifer Doudna – qui ont déjà attiré des dizaines de millions de dollars. Mais d’autres chercheurs sont en embuscade et comptent bien récupérer une part du gâteau. Pas besoin d’aller chercher bien loin... Au cœur même d’Editas, une guerre intestine est déjà en marche. En effet, un de ses cofondateurs – le chercheur Feng Zhang du Broad Institute à Cambridge – est parvenu à faire valider un brevet sur cette technologie aux États-Unis. De quoi faire réagir Charpentier et Doudna : l’affaire est aujourd’hui gérée par avocats interposés. Interrogée sur cette affaire, Emmanuelle Charpentier « ne souhaite pas commenter »... Bref, on n’a pas fini d’entendre parler de CRISPR-Cas9, et pas seulement à la rubrique « science » !
Et en biologie végétale ?
La technologie CRISPR trouve également des applications en biologie végétale. Pour en savoir plus, consultez notre entretien avec Agnès Ricroch, professeur de Génétique évolutive et amélioration des plantes à AgroParisTech, et Christian Huyghe, directeur scientifique adjoint agriculture de l’Inra : Sélection des plantes, une révolution en germe. 

