Des gènes corrigés grâce à Crispr-Cas9 chez des embryons humains
Nouvelle étape dans l’utilisation du « ciseau génétique » Crispr-Cas9 : des gènes défectueux chez des embryons humains ont pu être corrigés. Une première aux États-Unis.
Olivier Boulanger - Publié le
Le 2 août dernier, la revue Nature révélait qu’une équipe internationale (américano-sino-coréenne) était parvenue à corriger un gène défectueux dans des embryons humains.
Le gène en question, baptisé MYBCP3, est responsable lorsqu’il est muté d’une maladie grave affectant le muscle cardiaque : une cardiomyopathie hypertrophique. Actuellement sans traitement, cette maladie, qui touche une personne sur 500, peut provoquer à l’âge adulte des insuffisances cardiaques, voire des morts subites.
Pour éviter qu’un nouveau-né soit atteint du gène défectueux, seul le diagnostic préimplantatoire est aujourd’hui opérationnel. Le gène défectueux étant généralement porté par un seul brin d'ADN de l'un des parents, seuls 50% des embryons sont affectés. Des fécondations in vitro suivies d’un tri d’embryons permettent ainsi de sélectionner ceux qui pourront être implantés chez la mère.
La technique fonctionne, mais elle est lourde et réclame de nombreux embryons. Et c’est notamment pour tenter d’améliorer cette approche qu’une équipe internationale de l’Oregon Health & Science University de Portland a mis à profit les possibilités offertes par la technologie Crispr-Cas9, une approche récente permettant de modifier avec précision – et aussi avec une plus grande facilité – n’importe quelle séquence d’ADN.
Coup de ciseaux
L’expérience a consisté à traiter des embryons issus de la fécondation d’ovocytes de femmes en bonne santé par des spermatozoïdes d’un homme porteur de l’anomalie génétique. L’idée est de supprimer chez l’embryon, grâce à Crispr-Cas9, le gène défectueux : il sera remplacé naturellement par le gène sain de la mère lors de la réplication de la cellule.
Lors d’une expérience précédente menée en Chine en 2015, environ deux tiers des embryons ne présentaient plus de gènes mutés après traitement. Mais le tiers restant présentait encore des traces du gène défectueux, voire une mosaïque de cellules saines et anormales. Or ces mosaïques posent de nombreux problèmes : elles peuvent masquer le diagnostic de tri, et ne permettent pas de savoir si l’embryon développera ou non la maladie au cours de son développement.
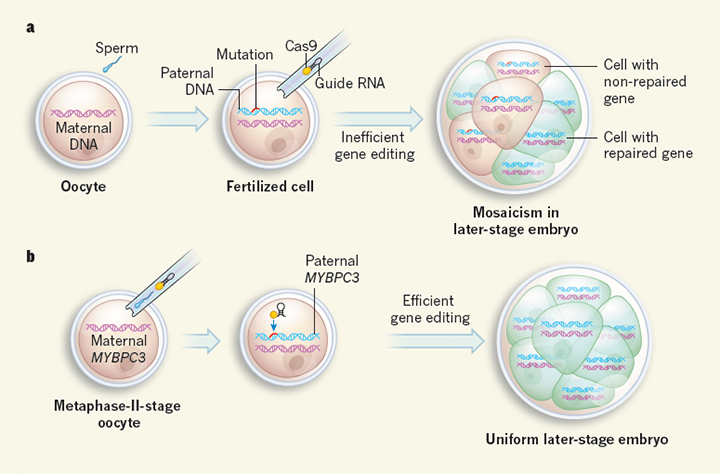
Or, en introduisant Crispr-Cas9 à une étape plus précoce – lors de l’introduction du spermatozoïde, et au stade II de la métaphase de l’ovocyte –, les chercheurs de l’université de l’Oregon ont pu améliorer le taux de réussite du traitement : lors de leur expérience, 72 % des embryons ne présentaient plus aucune trace du gène muté. Mais surtout, l’absence de mosaïques chez les autres embryons permet de s’assurer que le tri pourra être effectué sans ambiguïté.
Au-delà des aspects éthiques, le potentiel de la technologie Crispr chez l’humain semble donc en bonne voie. Mais l’approche reste expérimentale – les embryons ont été détruits – et il reste une marge de progression importante avant que des essais cliniques puissent être tentés chez l’Homme, tant sur le gène MYBPC3 que sur d’autres affections génétiques.
Pour tout savoir sur la technologie Crispr-Cas9
Retrouvez notre enquête : Crispr-Cas 9, le couteau suisse qui révolutionne la génétique

