Myopathie de Duchenne : le saut d'exon au service du muscle
Après des tests convaincants chez le chien, un essai clinique reposant sur une nouvelle stratégie de thérapie génique, élaborée par les laboratoires de recherche de l’AFM-Téléthon, devrait commencer en 2016. Cette technique permet de freiner la perte musculaire chez les patients atteints d’une myopathie de Duchenne, avec une seule injection par membre, là où plusieurs étaient nécessaires.
Roxane Tchernia - Publié le

Chaque premier week-end de décembre, l’Association française contre les myopathies (AFM) lance un appel à la générosité publique durant les trente heures d’antenne du Téléthon, avec un leitmotiv : les dons permettent à la recherche de progresser. La méthode de thérapie génétique qui a récemment permis de restaurer de la force musculaire dans les pattes avant de chiens golden retriever est un exemple des progrès accomplis. « On a voulu communiquer sur notre travail justement pour montrer que la recherche avance effectivement grâce à l’argent récolté », raconte Caroline Le Guiner, la scientifique qui a dirigé cette expérimentation. Les résultats, publiés début novembre dans la revue Molecular Therapy, offrent de nouvelles perspectives de traitement pour la dystrophie musculaire de Duchenne.
Causée par une anomalie du gène DMD sur le chromosome X, cette maladie s’exprime principalement chez les sujets masculins, dès l’enfance. En l’absence de dystrophine, protéine essentielle à l’architecture des fibres musculaires, les muscles des malades – muscles cardiaques inclus – s’atrophient et se nécrosent progressivement. La perte de la marche est généralement complète avant l’âge de 13 ans. D’après l’Inserm, entre 150 et 200 garçons naissent chaque année avec une myopathie de Duchenne. Les femmes, si elles sont souvent porteuses saines, peuvent néanmoins transmettre la maladie.
Cette maladie génétique neuromusculaire, qui ne s’exprime généralement que chez les garçons, provoque la dégradation progressive des tissus musculaires à cause de l’absence d’une protéine normalement constitutive de la structure de ces fibres : la dystrophine. Dans la myopathie de Duchenne, les mutations sur la séquence ADN du gène DMD (pour Duchenne muscular dystrophy), porté par le chromosome X, empêchent la synthèse de cette molécule. Pourtant, l’équipe de Caroline Le Guiner, chercheuse rattachée au centre Atlantic Gene Therapies à Nantes et au Généthon à Paris – deux des quatre laboratoires créés par l’AFM-Téléthon –, a réussi à rétablir la production de dystrophine dans la patte antérieure d’un chien en agissant directement sur le gène DMD, grâce à la technique dite du « saut d’exon ».
Développée depuis les années 1990, la méthode du « saut d’exon » n’est pas nouvelle. Il faut rappeler que c’est l’ADN qui contient l’information nécessaire à la synthèse d’une protéine, sur une séquence précise qu’on appelle le gène. Sur ce gène, certaines parties ne sont pas utiles à l’expression de la protéine : ce sont les introns. Pendant une phase appelée « épissage », ces introns sont naturellement éliminés de l’ARN, copie d’ADN utilisée pour fabriquer la protéine. Il ne reste alors que les portions codantes : les exons. Ce sont eux qui portent les mutations capables d’altérer la production d’une protéine. L’idée du « saut d’exon » est de profiter de l’épissage pour « sauter » les exons mutés. Pour y arriver, des molécules (oligonucléotides) dites antisens, capables de se fixer sur les sites de reconnaissance de l’exon muté, sont injectées dans les cellules. L’exon est alors masqué. Comme il n’est pas reconnu pendant l’épissage, il subit le même sort que les introns et disparaît de la séquence ARN. La protéine peut ainsi être à nouveau produite.
L’étude mentionne que près de 80 % des patients atteints d’une myopathie de Duchenne seraient éligibles à une thérapie par saut d’exon. « Cette technique ne fonctionne pas sur toutes les protéines », avertit toutefois Thomas Voit, directeur médical et scientifique de l’Institut de myologie à Paris (autre laboratoire de l’AFM-Téléthon) et donc pas pour toutes les maladies génétiques. La dystrophine offre cette possibilité, car elle possède dans son ADN des motifs de répétition qui peuvent être « sautés » sans l’altérer.
Utilisation d’un vecteur AAV
Dans les essais réalisés jusqu’alors, les molécules antisens entraînant le « saut d’exon » étaient injectées librement dans les muscles ou dans le circuit sanguin. « Le problème, c’est qu’il fallait renouveler l’injection chaque semaine et que le rétablissement restait limité », précise Thomas Voit. En effet, ce procédé permet de réexprimer une quantité limitée de dystrophine, suffisamment pour que les fibres musculaires ne se rompent pas, mais pas assez pour augmenter la force musculaire.
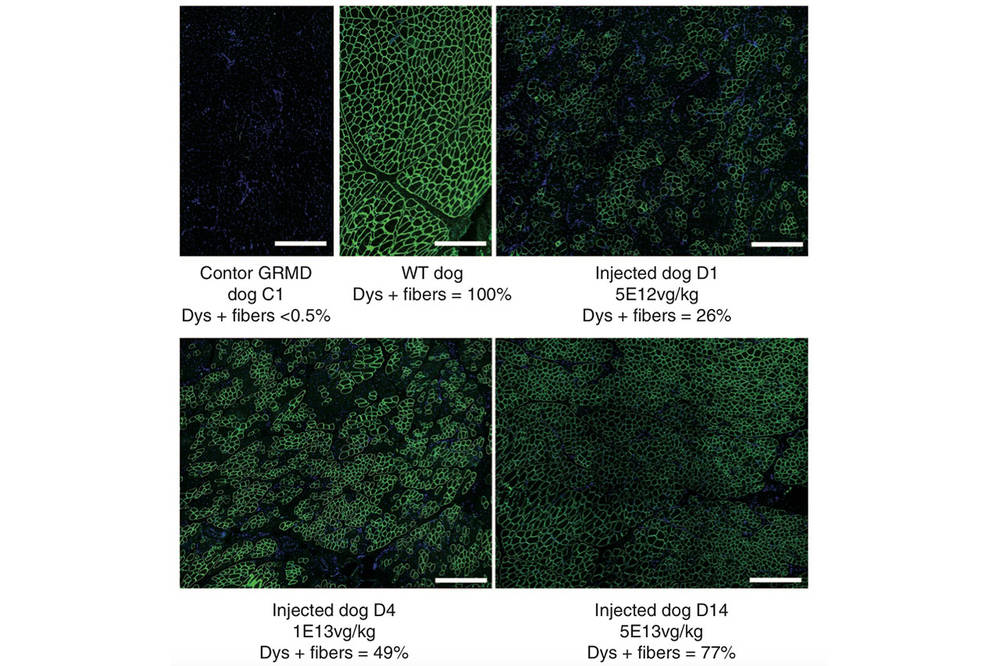
La nouveauté de la méthode testée par l’équipe de Caroline Le Guiner consiste à injecter dans l’organisme un vecteur virus contenant un gène modifié qui va produire, directement dans les cellules, les molécules permettant le « saut d’exon ». Les chercheurs ont utilisé un virus dit AAV (pour virus adéno-associé) qui présente la particularité d’être non pathogène tout en conservant la faculté virale de pénétrer dans les cellules.
En outre, ce virus reste actif longtemps, alors que les oligonucléotides antisens ont une faible durée de vie. L’usage d’un AAV évite donc d’avoir à renouveler régulièrement les injections. « Il faut que nous continuions nos recherches, mais au stade où nous en sommes, on peut espérer qu’une seule injection par membre suffira pour un traitement à vie », précise Caroline Le Guiner.
Des mutations différentes peuvent être à l’origine de l’absence de dystrophine. La stratégie de saut d’exon implique de produire un vecteur particulier pour chaque type d’anomalie. Une autre méthode thérapeutique devra donc être envisagée quand la mutation intervient sur un exon indispensable au fonctionnement de la protéine.
Injection par intraveineuse
Après la pose d’un garrot, le produit a été injecté dans le haut de la patte, au-dessus du coude. « C’est cette pression qui fait que ça fonctionne, bien qu’elle limite la diffusion et impose de procéder membre par membre », explique la scientifique. Les observations montrent qu’augmenter le volume injecté (à dose équivalente) améliore l’efficacité, en accentuant la pression pour créer un effet d’œdème transitoire. Cependant, « il y a des risques si les œdèmes sont trop forts. On est donc limité à certains volumes. »
Les chercheurs ont également fait varier d’autres paramètres. Il semble que le débit d’injection ne modifie pas les performances. Caroline Le Guiner conseille quant à elle d’opter pour des débits lents, de l’ordre d’une dizaine de millilitres par minute pour réduire le risque de rupture des vaisseaux sanguins. Concernant la dose, les effets les plus appréciables ont été obtenus pour l’introduction de 5. 1013 particules de virus par kilogramme (en se rapportant au poids total de l’animal), c’est-à-dire 50 000 milliards ! « La production de vecteurs médicaments en quantité est un élément qui risque de limiter l’application de cette technique », reconnaît la responsable de l’étude.
Des bras au reste du corps
À haute dose, près de 80 % des fibres musculaires ont exprimé la dystrophine. Elles sont alors consolidées et protégées, ce qui permet de retrouver un peu de force musculaire. « Ce traitement est un système de conservation. Il permet de réinsuffler de la dystrophine dans les fibres musculaires encore intactes, souligne Caroline Le Guiner, l’idée est de stopper la progression de la maladie. »
C’est pourquoi l’expérience a été réalisée sur les membres supérieurs des chiens. Dans l’essai clinique sur l’Homme, les patients volontaires se déplaçant en fauteuil n’auront plus l’usage de leurs jambes. L’objectif sera de leur redonner de la force dans les bras.
Pour Caroline Le Guiner, « à terme, il faudra pouvoir guérir le corps entier. » Pour cela, les patients devront être traités plus jeunes, dès l’enfance, avant que les fibres musculaires ne soient rompues. Ceci ne sera envisageable que si les résultats de l’essai clinique, qui doit commencer d’ici 2016, sont concluants. Il faudra sans doute attendre quelques années pour être fixé.

