Trisomie 21 : sur la piste de la thérapie chromosomique
Pour la première fois, des chercheurs américains sont parvenus à inactiver l'un des trois chromosomes responsable de la trisomie 21. Le but visé : développer une nouvelle stratégie de traitement par thérapie chromosomique et améliorer les outils d'étude de la maladie.
Julie Lacaze - Publié le

Les troubles de la trisomie 21 sont liés à la présence de trois exemplaires du chromosome 21 au lieu de deux. Or, le 17 juillet dernier, des chercheurs de l’école de médecine du Massachusetts ont réussi à inactiver le chromosome surnuméraire, ouvrant la voie à une nouvelle approche thérapeutique : la thérapie chromosomique.
Soigner la trisomie 21… ce rêve un peu fou est né dans l’esprit des chercheurs il y a une dizaine d’années, et, jusqu’à présent, deux stratégies se sont majoritairement imposées. La première d’entre elles consiste à soigner les pathologies associées à la maladie (comme les anomalies cardiaques, les troubles mentaux précoces, etc.). La seconde tente de modifier – par thérapie génique – les gènes responsables des principaux troubles du développement. Aujourd’hui, l’équipe de scientifiques américains explore une troisième voie : « la thérapie chromosomique » par neutralisation pure et simple de l’expression du chromosome 21 supplémentaire. L’expression de ce chromosome supplémentaire, entraînant une surdose de gènes, est responsable des dysfonctionnements cognitifs et anatomiques chez les individus trisomiques.
Les origines de la trisomie 21
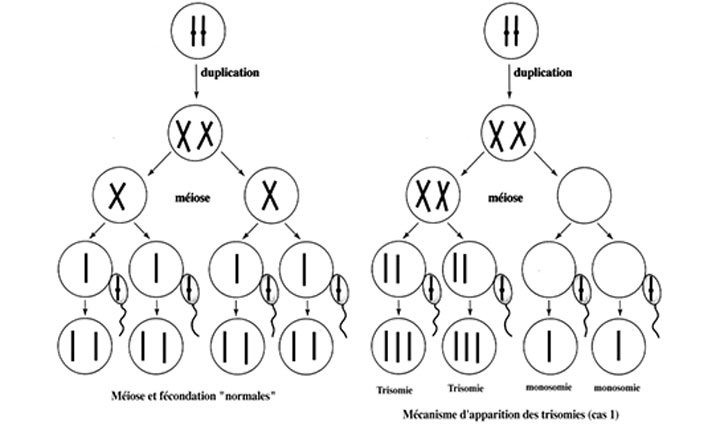
La trisomie 21 est la première cause de déficit mental en France. Cette maladie, appelée également syndrome de Down, est issue d’un défaut du nombre de chromosomes. Il existe différents scénarios possibles conduisant à l’apparition de la maladie, mais dans la plupart des cas l’origine est maternelle. Un accident génétique lors de la production de l’ovule (en phase I ou II de méiose) empêche les deux chromosomes 21 de se séparer, formant ainsi des cellules contenant deux exemplaires du même chromosome. Lors de la fécondation, le spermatozoïde apporte un troisième chromosome 21 : les cellules de l’individu sont alors trisomiques.
Un modèle inspiré du chromosome X
Pour parvenir à leurs fins, les chercheurs de l’école de médecine du Massachusetts se sont inspirés d’un modèle naturel : l’inactivation du chromosome X chez la femme. Contrairement à l’homme dont les chromosomes sexuels sont X et Y, la femme possède deux copies du chromosome X. Afin d’éviter, comme dans la trisomie, la surexpression de certains gènes dit à « effet de dose », l’un des deux chromosomes X de la femme est naturellement inactivé. Cet événement se produit au cours du développement embryonnaire grâce à l’expression d’un gène nommé Xist. Pourquoi ne pas utiliser ce gène pour éteindre l’un des trois chromosomes 21 ? L’idée est venue à l’esprit du Dr Jeanne Lawrence, l’un des auteurs de ces travaux, après avoir étudié pendant plusieurs années le phénomène chez la femme. Reste que la réussite de l’expérience n’était pas garantie concernant le chromosome 21.
Les chercheurs ont d’abord dû isoler la séquence du gène Xist qui inactive le « X » des femmes pour ensuite le transplanter dans le noyau de cellules iPS (ou cellules souches pluripotentes induites) humaines trisomiques. Mais après ces manipulations, le petit miracle s’est bien produit. Le chromosome supplémentaire, condensé contre la paroi du noyau cellulaire, est devenu inerte. La forme qu’il adopte, un corpuscule dit « de Barr » également présent dans les cellules féminines dont le X est inactivé, rend l’ADN inaccessible à la machinerie cellulaire. Autrement dit, le troisième chromosome 21 est toujours présent mais ne peut plus s’exprimer et produire de protéines. In vitro, l’expression génétique est diminuée d’environ 20 %. Le phénomène est partiel mais proche du modèle théorique fixé à 22 %. Ce système reste donc expérimental mais permet d’envisager la possibilité de limiter la surexpression génétique ou « effet de dose » responsable des symptômes de la trisomie 21.
Un effet de dose
 L'effet de dose expliqué par Aude-Marie Lepagnol-Bestel du Laboratoire de génomique fonctionnelle du Centre d'énergie atomique (CEA), du Centre national de génotypage et de l'Institut de génomique © CEA
L'effet de dose expliqué par Aude-Marie Lepagnol-Bestel du Laboratoire de génomique fonctionnelle du Centre d'énergie atomique (CEA), du Centre national de génotypage et de l'Institut de génomique © CEA
Le chromosome 21 supplémentaire provoque des dysfonctionnements d’expression des gènes à tous les niveaux. C’est ce qu’on appelle « un effet de dose ». Le mauvais dosage de ces gènes affecte la mise en place des structures anatomiques à un stade très précoce du développement embryonnaire. Par exemple, le gène DYRK1A du chromosome 21 est normalement responsable de la migration et de la différenciation des cellules en neurones. Mais il devient le premier coupable des troubles mentaux lorsqu’il est surexprimé. Après la naissance, d’autres troubles peuvent apparaître à cause de la présence de ces gènes à « effet de dose ». Certaines protéines surexprimées entraînent des perturbations cognitives, comme la protéine APP qui est responsable de l’apparition précoce, vers 40 ans, de la maladie d’Alzheimer chez les sujets trisomiques.
Du labo à la thérapie
Serait-il possible de remplacer les cellules trisomiques de certains organes par ces cellules modifiées en laboratoire ? Pas complètement. Comme le souligne le Docteur Yann Hérault, chef d'équipe à l'Institut de génétique et de biologie moléculaire et cellulaire du CNRS à Illkrich, il est inconcevable de regreffer toutes les cellules des patients : « Mais substituer certaines cellules afin, par exemple, d’obtenir une pathologie en mosaïque (la moitié des cellules du patient est saine, l’autre moitié est trisomique) est un peu plus envisageable ». Les patients « mosaïque » ont de bien meilleures performances intellectuelles que les autres individus trisomiques. Mais si le traitement est possible, il doit être prodigué très tôt car les perturbations cognitives et anatomiques sont irréversibles et se déroulent lors des premiers stades du développement embryonnaire de l’individu. Les résultats sont tout de même encourageants. « Il y a 10 ans, on ne pensait pas du tout guérir ces maladies. Pourtant, aujourd’hui, on développe de réelles pistes de traitement », explique le Dr Hérault.
 'De nouveaux outils d'étude de la Trisomie 21'. Aude-Marie Lepagnol-Bestel Explication d'Aude-Marie Lepagnol-Bestel du laboratoire de génomique fonctionnelle du Centre d'énergie atomique, du Centre National de Génotypage et de l'Institut de Génomique. © CEA
'De nouveaux outils d'étude de la Trisomie 21'. Aude-Marie Lepagnol-Bestel Explication d'Aude-Marie Lepagnol-Bestel du laboratoire de génomique fonctionnelle du Centre d'énergie atomique, du Centre National de Génotypage et de l'Institut de Génomique. © CEA
Reste à savoir si ce modèle est efficace chez un organisme vivant. Des études sont actuellement menées chez la souris. « Nous sommes en train de travailler sur l’insertion du gène Xist dans les cellules iPS chez des souris trisomiques et nous étudions le comportement de différents types cellulaires après différenciation », explique la chercheuse Lisa Hall, membre de l’équipe américaine. Bien que l’inactivation du chromosome 21 semble être assez stable in vitro, « il va falloir observer comment le système se comporte sur le long terme d’abord chez les cobayes », précise aussi le Dr Hérault. Mais que ce modèle fonctionne dans un organisme vivant ne signifie pas qu’il fonctionnera également chez l’homme.
Le Dr Lisa Hall est consciente que ce travail n’offre pas de solution de traitement à court terme mais espère bien qu’il fournira un outil d’étude du syndrome de Down « si mal financé et même un peu négligé ». Ce travail permettra aussi, selon la chercheuse, « d’aider au développement de médicaments afin d’atténuer certains des aspects les plus préjudiciables de la maladie comme les malformations cardiaques, la maladie d’Alzheimer, la leucémie et les déficits cognitifs ».
Les débuts de la thérapie chromosomique
Une équipe de recherche de l’école de médecine de Washington était déjà parvenue, le 18 octobre 2012, à retirer un chromosome 21. Cependant la méthode utilisée pour atteindre cet objectif n’était pas issue d’un processus naturel d’inactivation. Les chercheurs avaient introduit un gène, agissant comme un élément « toxique »pour la cellule, qui entraîna l’expulsion du chromosome.

