Un enfant à trois parents, vraiment ?
Nouvel épisode dans le domaine de l'assistance médicale à la reproduction : le Royaume-Uni a autorisé la FIV avec transfert du noyau dans l’ovocyte d’une donneuse. L'objectif est d'éviter la transmission de maladies de l’ADN mitochondrial. Un protocole expérimental et prometteur, mais qui remet en cause l'interdiction pesant sur la manipulation du patrimoine génétique.
Barbara Vignaux - Publié le
Le noyau cellulaire de la mère est placé dans l'ovule d'une donneuse, ainsi que le spermatozoïde du père. L'œuf contient ainsi trois ADN : celui de la mère, l'ADN mitochondrial de la donneuse et l'ADN du père.
© Olivier Boulanger/Universcience
Un nouvel épisode s'ouvre dans l'histoire de l'assistance médicale à la reproduction. Le 3 février dernier, en effet, une nouvelle technique de fécondation in vitro a été autorisée Outre-Manche pour la première fois au monde : la FIV avec remplacement mitochondrial, aussi appelée « transfert nucléaire ». Il s’agit d’une modification à la loi britannique, datant de 2008, sur l’embryologie et la fertilisation humaine. Cette méthode, qui combine trois ADN, est destinée à prévenir la transmission de maladies du dysfonctionnement mitochondrial, en recourant au cytoplasme d’une donneuse.
Le vote du Parlement britannique intervient au terme de longs débats, marqués notamment par plusieurs prises de position du Nuffield Council sur la bioéthique et de la Société britannique de fertilité (BFS) – plutôt favorables, d’ailleurs, à l’expérience, à des fins thérapeutiques. La BFS écrivait même, le 3 février, être « enchantée » (delighted) par le vote de la loi et « fière » des recherches conduites à l’université de Newcastle.
Le promoteur de cette technique est le professeur émérite des études en fertilité à l’Imperial College de Londres, Robert Winston. Concrètement, il s’agit de transférer le noyau de la mère dans une cellule receveuse saine préalablement énuclée. La technique employée vise à bloquer la transmission de la maladie de la mère à l’enfant en retirant de l’ovule de la mère les mitochondries défectueuses pour les remplacer par des mitochondries saines provenant d’une autre femme. Une fois fécondé par le sperme du père en laboratoire, l’ovule est implanté dans l’utérus de la mère.
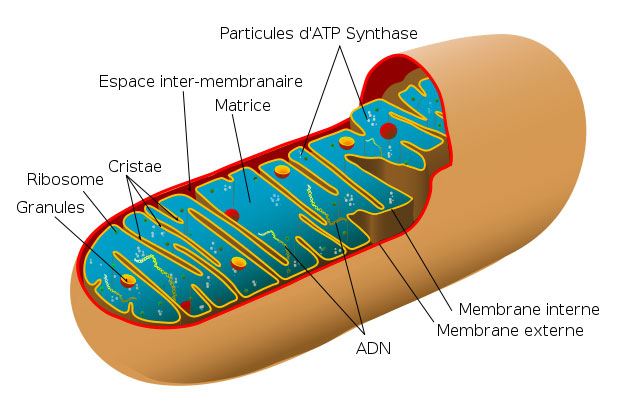
Difficiles à diagnostiquer, les mutations de l’ADNmt sont responsables de maladies graves, sans traitement à ce jour. « Elles peuvent toucher tous les organes – le muscle, l’œil, le pancréas, le rein – et entraîner des maladies telles que le diabète, la surdité, des migraines, une myopathie, le syndrome de Leigh, mortel à brève échéance, ou la neuropathie optique de Leber qui entraîne la cécité… » explique le Dr Julie Steffann, biologiste au service de génétique médicale de l’hôpital Necker, à Paris. « En général, plus le taux de mutation est élevé, plus le risque de développer une forme sévère croît ».
Les femmes atteintes d’une mutation de l’ADNmt et souhaitant avoir un enfant indemne n’ont guère le choix : procéder à un diagnostic préimplantatoire (DPI) afin de sélectionner les embryons porteurs du taux de mutation le plus faible possible ; réaliser un diagnostic prénatal pour ne conserver que les fœtus indemnes ; ou recourir au don d’ovocytes. Cette dernière solution est la plus sûre pour le futur enfant, mais ne permet de transmettre que le patrimoine génétique paternel. Jusqu’à présent, elle était aussi la seule possible dans les situations dites « homoplasmiques », c’est-à-dire lorsque toutes les copies d’ADNmt portent la mutation, ce qui se traduit par une probabilité de 100 % de mutation de l’ADNmt chez l’embryon. Tout en évitant la transmission de la maladie, le transfert nucléaire permet de livrer à l’enfant les caractéristiques génétiques de son père et de sa mère. C’est d’ailleurs la raison pour laquelle, selon Michaël Grynberg, le chef du service Médecine de la reproduction à l’hôpital Jean Verdier à Bondy (Seine-Saint-Denis), « cette technique est intéressante conceptuellement ».
Un simple « changement d’enveloppe » ?
Concrètement, s’agit-il d’un banal changement d’enveloppe du noyau cellulaire, autrement dit du cytoplasme, par une simple micromanipulation ? C’est l’hypothèse défendue – avec des nuances – par Robert Winston, qui écrit, dans un éditorial paru dans The Telegraph et disponible sur son blog, que cette technique « n’altère pas les caractéristiques de l’enfant, ni n’augmente (enhance) l’être humain ». L’ADN mitochondrial représente moins de 1% de la quantité totale d’ADN contenue dans une cellule humaine. Pour le médecin anglais, donc, le transfert nucléaire peut être comparé, en son principe, à une transfusion de sang à une personne anémiée.
De fait, l’expression « enfant à trois parents » lue dans une grande partie de la presse est totalement absurde, comme le souligne Pierre Jouannet, un pionnier de la procréation médicale assistée en France (PMA), ancien président de la fédération des Cecos (Centres d’étude et de conservation des œufs et du sperme) et membre de l’Académie de médecine : « La parenté génétique passe par les gènes nucléaires, pas par les gènes mitochondriaux ! Il y a donc bel et bien deux parents et non pas trois ».
Robert Winston – qui n’a pas souhaité répondre à nos questions – avance aussi que l’idée même du transfert nucléaire n’est pas neuve. Certes, mais le précédent qu’il invoque – aux Etats-Unis, il y a quinze ans – visait un autre objectif : « Avant, c’était pour lutter contre l’infertilité en accroissant les chances de réussite d’une FIV ; aujourd’hui, c’est destiné à prévenir des maladies génétiques », explique le Pr Grynberg.
En outre, la technique elle-même diffère. « Aux Etats-Unis, explique Julie Steffann, biologiste au service de génétique médicale de l’hôpital Necker, à Paris, on aspirait un peu de liquide cytoplasmique dans l’ovocyte d’une donneuse pour le réinjecter dans celui de la mère. Cela aboutissait à mélanger les mitochondries des deux femmes, mais dans une proportion de 5 % d’ADNmt de la donneuse. Avec la technique actuelle, ce taux est de 99 % – le taux de 100 % est impossible à atteindre car un noyau est toujours prélevé avec un peu de cytoplasme ».
C’est une méthode qui s’apparente à celle utilisée dans le clonage – même si le but diffère, naturellement, puisque le futur individu ne sera pas identique à sa mère. En revanche, le noyau est transféré dans un ovocyte se trouvant au même stade de développement que lui – ce qui n’est pas le cas dans le clonage, où est transférée une cellule d’adulte dans un ovule vidé de son noyau – ce qui devrait faciliter le développement de l’embryon.
Des risques difficiles à mesurer
La manipulation elle-même ne présente pas, a priori, de difficulté particulière. « On pourrait croire qu’il s’agit d’une intervention très agressive pour l’embryon, mais on peut la mettre en regard de la procédure employée pour le DPI – l’extraction de deux cellules sur huit au troisième jour du développement embryonnaire – ou de la scission en deux pour constituer des jumeaux, comme cela se produit spontanément », souligne Pierre Jouannet, « l’embryon est à la fois très fragile et d’une plasticité extraordinaire. Je ne vois donc pas de problème éthique majeur lié à la manipulation ».
En revanche, les interactions entre mitochondries et ADN nucléaire, essentielles au fonctionnement cellulaire, restent mal connues. « La nature a fait en sorte qu’on n’ait qu’une seule population de mitochondries, explique Julie Steffann, puisque celles du spermatozoïde sont toutes détruites juste après la fécondation. Or, à ce jour, on ignore encore pourquoi ». L’embryon puis l’enfant ne risquent-ils pas de souffrir d’anomalies développementales ? Michaël Grynberg s’interroge : « L’ADN mitochondrial est-il en quelque sorte secondaire ? Quels pourrait être l’effet du transfert nucléaire sur l’expression des gènes du noyau ? On n’en sait rien ! » Encore peu nombreuses, les études conduites sur les animaux – la souris puis le primate – ne permettent pas non plus de tirer de conclusion définitive à ce sujet.
Une portée pratique limitée
De fait, la loi britannique prévoit un strict encadrement de la mise en œuvre de cette technique. Les femmes qui voudront en bénéficier devront obtenir l’autorisation de l’organisme britannique responsable en matière de bioéthique, la HFEA (Human fertilisation and embryology authority). Les premiers bébés pourraient naître à l’automne 2016.
Ils devraient être très peu nombreux. D’ailleurs, le nombre de femmes à risque de transmettre une maladie de l’ADNmt est lui-même très faible. Dans une étude parue en janvier 2015 dans le New England Journal of Medicine, des chercheurs de l’université de Newcastle l’évaluent à 2 473 femmes au Royaume-Uni et 12 423 femmes aux Etats-Unis. Quant au nombre moyen de naissances annuelles, il atteindrait respectivement 152 et 778 dans les deux pays.
Mais il s’agit naturellement d’un plafond. Rien n’indique, en effet, que toutes ces femmes voudront avoir un enfant ou accepteront de suivre un protocole expérimental aux risques non maîtrisés et impliquant un suivi de leur enfant sur plusieurs années. Et ce, alors que les chances de succès d’une FIV ordinaire ne sont déjà pas très élevées (moins de 20 % en France) et que le don d’ovocytes peut donner de meilleurs résultats. D’ailleurs, relève Julie Steffann, le service de génétique médicale de l’hôpital Necker – un des rares laboratoires au monde à effectuer le DPI des maladies de l’ADNmt – ne procède qu’à une ou deux analyses par an. « Les femmes préfèrent faire leur bébé sans passer par notre service », explique Julie Steffann, en recourant au don d’ovocytes, à l’adoption ou au dépistage prénatal.
Transmettre coûte que coûte ?
Certes, souligne Robert Winston, la prise de risque est inhérente au progrès scientifique. On a couru des risques également lorsqu’on a commencé à pratiquer des FIV… Mais ce qui apparaît radicalement nouveau, avec le transfert nucléaire, « c’est qu’on modifie le capital génétique de l’individu et de sa descendance. Or il existe un consensus sur l’acceptation de la thérapie génique à des fins thérapeutiques, mais sans transmission à la génération suivante. Le jeu en vaut-il la chandelle ? », s’interroge Pierre Jouannet.
La thérapie génique germinale (ou sexuelle) consiste à appliquer un procédé de thérapie génique à un embryon (ou aux cellules germinales d’un adulte, ovules ou spermatozoïdes). La modification est de ce fait transmise aux cellules filles des premières cellules embryonnaires, c’est-à-dire aux cellules du futur individu. De ce fait, il se produit une modification du patrimoine génétique de l’espèce humaine. En outre, les cellules germinales du futur individu étant touchées comme les autres, le nouveau patrimoine sera transmis héréditairement à toute sa descendance.
Une telle technique viole l’interdiction, sinon le tabou, relatif à la non-modification par l’Homme du patrimoine héréditaire de l’être humain. Dans une tribune parue dans Nature le 11 juillet 2013, la directrice du Centre pour la génétique et la société de Berkeley, Marcy Darnovsky, adoptait sur ce sujet une position tranchée : autoriser cette technique « ouvrirait grand la porte à la manipulation germinale, impulsant une dynamique sociale d’eugénisme high-tech ». Et de regretter qu’aux Etats-Unis, une demande d’autorisation de procéder à des essais de transfert nucléaire doive également être bientôt déposée.
En France, la question sera sans doute soulevée au cours des années à venir. Dans une note du 31 mai 2014 intitulée État de la recherche sur l’embryon humain et propositions, le Comité d’éthique de l’Inserm relevait qu’il n’y abordait pas certains sujets, « comme les modifications embryonnaires assimilables à une thérapeutique génique germinale », mais devrait sans doute se saisir de la question durant ses prochaines sessions.
« Conserver coûte que coûte l’héritage génétique », selon l’expression du Pr Grynberg, justifie-t-il une telle avancée technique et peut-être une telle rupture éthique ? C’est la question que soulève aujourd’hui la mise en œuvre du transfert nucléaire.

