Une guêpe tueuse... de cancer
Le venin d’une guêpe brésilienne est capable de détruire certaines cellules cancéreuses. Comme le démontrent les chercheurs, c’est grâce à la coopération de deux protéines que ce processus opère. Une découverte qui pourrait aboutir à la mise au point d'une nouvelle classe de médicaments contre le cancer.
Sophie Félix - Publié le

Même quand on n'y est pas allergique, une piqure de guêpe n’est jamais agréable. Pourtant le venin de la guêpe Polybia paulista pourrait être très utile. La molécule MP1 qu’il contient détruit en effet les cellules cancéreuses et intéresse les chercheurs. Publiée le 1er septembre dans la revue Biophysical Journal, une étude détaille le rôle de deux protéines dans cette destruction : l’une facilite l’ancrage de MP1 sur la membrane cellulaire, tandis que l’autre favorise la formation de larges défauts dans cette membrane.
Inspiré par la nature
Le venin de la guêpe brésilienne Polybia paulista contient en effet une molécule appelée Polybia-MP1, ou simplement MP1, qui possède des propriétés antibactériennes. De façon surprenante, elle détruit également les cellules cancéreuses de la vessie et de la prostate et les cellules leucémiques résistantes aux médicaments, par une méthode ciblée et simple en apparence : la molécule crée des trous dans la membrane des cellules malades, et uniquement celles-ci.
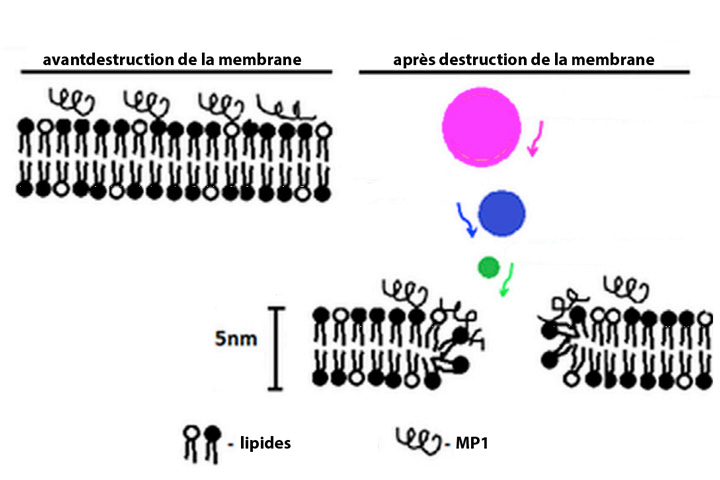
Mais comment choisit-elle à qui s’attaquer et comment crée-t-elle ces défauts de structure ? Les cellules cancéreuses, et plus généralement les cellules en fin de vie, perdent la distribution asymétrique de lipides présente dans les membranes des cellules saines. En particulier, le lipide phosphatidylsérine (PS) devient majoritaire sur la face externe de la membrane. Or, pour passer d’un côté à l’autre, PS utilise un « transporteur », une famille de protéines assurant le transport transmembranaire, qu’il partage avec une autre protéine, phosphatidyléthanolamine (PE). Quand PS prédomine à l’extérieur de la cellule, PE y est donc aussi en plus grande quantité.
Cet excès de PS et PE en surface est donc typique des cellules cancéreuses et représente un bon moyen de les identifier. La molécule MP1 de la guêpe semble tirer profit de ces protéines. Des chercheurs brésiliens et anglais, emmenés par l'université fédérale Paulista Júlio de Mesquita Filho (UNESP) de São Paulo au Brésil, ont voulu déterminer le rôle exact de PS et PE dans la destruction des cellules. Pour cela, ils ont fabriqué un modèle de membrane cellulaire en présence de MP1 seule, avec PS et/ou avec PE.
PS accroche et PE soutient
C’est MP1 qui perce la membrane des cellules. Mais pour cela, elle doit d’abord s’y accrocher. La présence de PS sur la membrane en fait une anode (pôle négatif) qui attire plus la molécule MP1 qui joue le rôle de cathode (pôle positif). Ainsi, PS multiplie par 7 ou 8 la quantité de MP1 liée à la membrane des cellules cancéreuses. En revanche, l’ajout de PE diminue cet avantage d’environ 10 %.
D’un autre côté, l’excès de PE rend la surface de la cellule plus susceptible de se dégrader. Les chercheurs ont ainsi mesuré le passage de trois colorants fluorescents à travers la membrane cellulaire exposée à MP1 et à PS ou PE pendant 30 minutes. Les molécules de colorant ont des tailles différentes en fonction de la couleur : le vert est le plus petit, le magenta le plus grand et le colorant bleu a une taille intermédiaire. Par microscopie à fluorescence, les chercheurs ont pu suivre ces colorants et ont montré que, pour une concentration de MP1 donnée, plus de colorants entraient dans la cellule en présence de PE.
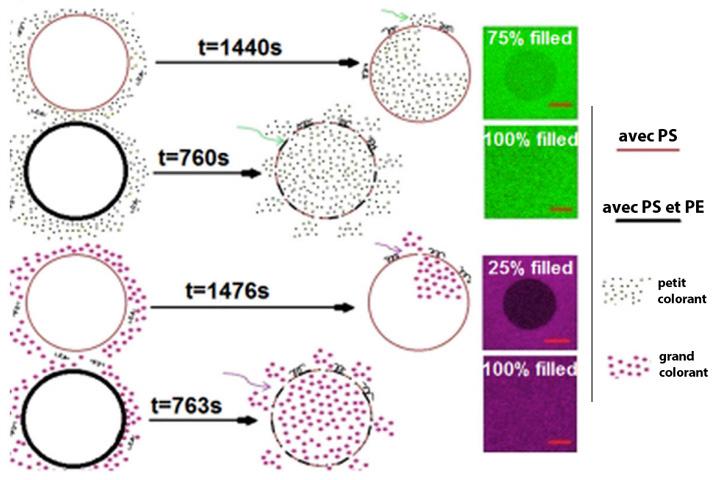
En particulier, PE facilite l’apparition et le développement rapide de larges pores : 98 % des membranes en ont en présence de PE, contre moins de 60 % sans. Les grosses molécules magenta entrent donc plus facilement dans la cellule si PE est présent. Dans la réalité, ces molécules magenta pourraient être des protéines, voire de l’ARN alors capables de quitter la cellule, ce qui signerait son arrêt de mort.
Les pores apparaissent aussi plus vite en présence de PE et évoluent rapidement vers de larges trous : il suffit de quelques secondes pour que le colorant magenta remplisse la cellule, quand il faut attendre plusieurs dizaines de minutes pour un remplissage incomplet lorsque MP1 est seule. Ainsi, le développement des pores est dix fois plus rapide en présence de PE qu’en présence de PS, lui-même quatre fois plus rapide qu’en l’absence de lipides.
Les chercheurs ont pu photographier les trous directement avec un microscope. Ils apparaissent plus grands en présence de PE : ils atteignent ainsi 250 nanomètres de diamètre, contre 54 nm sans PE. Ils sont également plus nombreux si l’on ajoute PS. Au final, un fluide peut passer à travers la membrane cellulaire à plus de 500 nm/s alors que la vitesse ne dépasse pas 25 nm/s habituellement.

Au contraire de PE, PS diminue la taille des pores sur la surface cellulaire. PE et PS ont donc des fonctions contradictoires. Mais lorsque les deux protéines travaillent ensemble, elles dépassent leurs défauts respectifs et font une belle équipe : PS compense le moindre ancrage de PE et permet de lier de nombreuses molécules MP1 à la surface, tandis que PE compense la moindre porosité due à PS et permet à MP1 de percer la membrane de toute part. La cellule cancéreuse ne peut survivre à un tel traitement. Les scientifiques ont même montré que la mort des cellules répondait à la règle du « tout ou rien » : la cellule perd entièrement son contenu ou reste intacte. Il n’y a pas de demi-mesure où toutes les cellules perdraient seulement une partie de leur contenu. Cela prouve que, quand il y a des pores, ils durent suffisamment longtemps pour que tout le contenu ait le temps de sortir. PE inhibe donc la réparation cellulaire qui pourrait reboucher les trous.
Une méthode originale
Mais PE va même plus loin et modifie la façon dont ces trous se forment. Sans lui, des lipides s’agglomèrent en certains points de la membrane avant la formation d’un trou. Cela n’est pas vu en présence de PE : les pores se forment alors plus progressivement, les lipides disparaissant petit à petit depuis le bord externe des pores. Selon les auteurs, ce nouveau mécanisme et les capacités de MP1 en association avec PE et PS devraient permettre la mise en place d’une nouvelle forme de chimiothérapie capable de cibler correctement les cellules à détruire. Les scientifiques pourraient aussi s’inspirer de du venin de Polybia paulista pour délivrer plus facilement un médicament directement au cœur de cellules malades, en y creusant un passage. Finalement la guêpe pourrait bien sauver des vies...

