Greffes : l’espoir de l’impression 3D
Pour s’affranchir de la pénurie d’organes chez les patients en attente d’une greffe, des laboratoires se lancent dans l’impression 3D de tissus humains. Avec quels avantages et quelles limites ?
Enquête de Pierre-Yves Bocquet - Publié le
Peau, os, cartilage, veines… Les échantillons de tissus vivants « bio-imprimés », c’est-à-dire fabriqués à l’aide d’imprimantes 3D utilisant des cellules biologiques (notamment les cellules souches), ne sont plus du domaine de la science-fiction : ils ont déjà vu le jour en laboratoire. Les premières bio-imprimantes 3D sont même déjà en vente. Et ce n’est probablement qu’un début. Grâce aux progrès en cours dans diverses disciplines pour mettre au point des machines de plus en plus précises et performantes, des organes plus complexes, tels que le rein, le foie ou le cœur pourront peut-être un jour être fabriqués à la demande. Une véritable révolution en perspective pour la médecine réparatrice, qui pourra alors s’affranchir de la pénurie chronique de greffons. Avec en toile de fond, le fantasme de l’Homme immortel, capable de se réparer à l’envi...
Les prothèses ouvrent la voie
En juillet 2017, l’École polytechnique fédérale de Zurich a annoncé avoir réussi à faire fonctionner ce cœur de forme et de taille humaine, imprimé en silicone souple. Une étape marquante qui s’inscrit dans les progrès réalisés depuis une dizaine d’années dans l’impression 3D des prothèses médicales. Cependant, les prothèses ne comportent pas de cellules vivantes et n’entrent donc pas directement dans le champ de la bio-impression.

Des organes à volonté
Imprimer des organes à la demande permettrait de résoudre le problème de pénurie chronique de greffons.
L’impression d’organes vivants fait l’objet de nombreuses recherches. En effet, si elle parvenait à passer du laboratoire au stade clinique, elle pourrait tout simplement révolutionner la chirurgie réparatrice. La greffe d’organes (rein, cœur, foie, poumon...) issus de donneurs est en effet maîtrisée de longue date, mais elle souffre toujours d’une limite jusqu’ici indépassable : la pénurie d’organes disponibles. Selon l’Agence de la biomédecine (ministère de la Santé), 5 891 transplantations ont été réalisées en France en 2016, sur un total de 22 617 malades en attente d’une greffe, soit un quart des besoins couverts seulement. Un chiffre d’autant plus faible qu’une partie de ces transplantations sont touchées par des rejets, encore fréquents (près de 20 % à cinq ans pour le rein) malgré les traitements médicamenteux (des lacunes que la bio-impression pourrait bien combler). Or l’impression d’organes vivants pourrait non seulement compenser l’insuffisance chronique de donneurs et les refus des familles, mais en utilisant des cellules issues du patient à greffer, elle réduirait aussi drastiquement le risque de rejet. Les tissus bio-imprimés intéressent également les industries de la pharmacie et de la cosmétique. Ces dernières pourraient en effet les utiliser pour éviter le recours aux tests in vivo sur l’animal, lorsqu’elles veulent tester l’efficacité ou la toxicité de nouvelles molécules avant leur mise sur le marché.
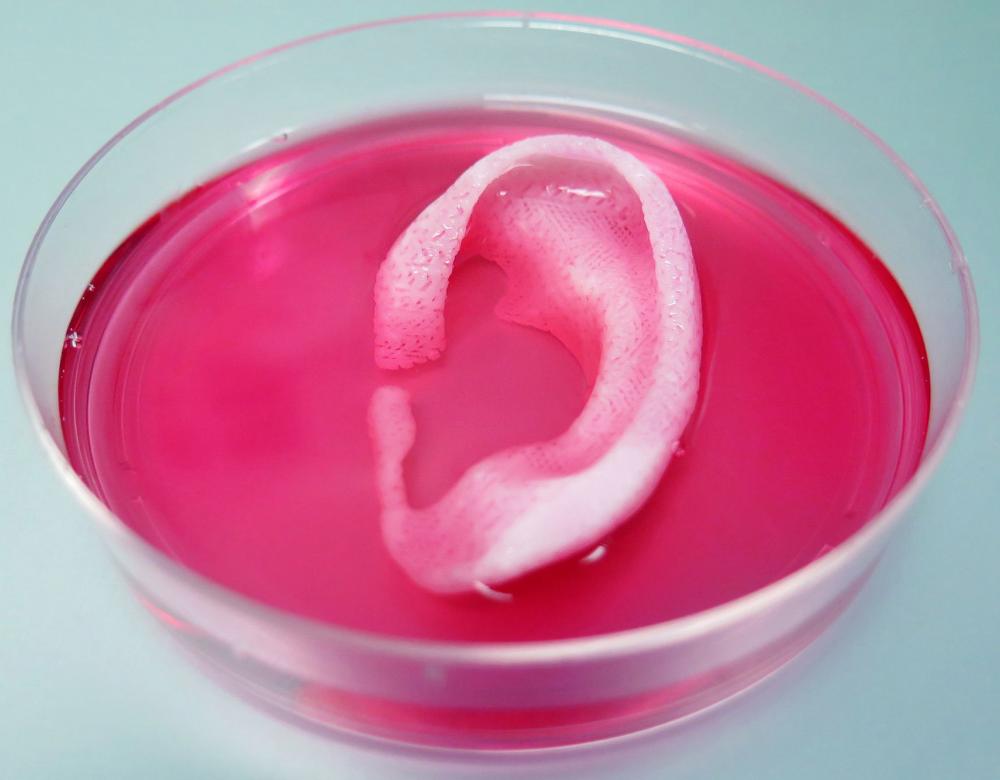
Une oreille in vitro
Cet impressionnant cartilage d’oreille imprimé par des chercheurs de l’université Wake Forest (Caroline du Nord, États-Unis) a été obtenu en effectuant un scanner (tomodensitométrie) d’une oreille, ce qui a permis d’en obtenir un modèle 3D numérique. Ce fichier a ensuite été converti pour être envoyé à l’imprimante et fabriqué à partir de cellules vivantes, afin d’obtenir ce cartilage de 3,2 cm × 1,6 cm × 0,9 cm. Ce dernier s’est avéré viable pendant plusieurs semaines, selon l’article publié en février 2016 dans la revue Nature Biotechnology. Reste à démontrer qu’il serait toléré chez des patients, sur le long terme.
Du plastique au vivant
Les techniques d’impression 3D ne cessent de se diversifier et de s’étendre à un éventail de plus en plus large de matériaux, jusqu’aux cellules vivantes.
La bio-impression (de cellules, tissus ou organes) représente l’ultime étape du développement des technologies d’impression 3D, apparues dans les années 1990. La première d’entre elles, la stéréolithographie par photo-polymérisation, est née en 1986. Elle consiste à déposer une fine épaisseur de résine polymère liquide, solidifiée couche après couche par rayonnement ultraviolet. Depuis, les techniques se sont diversifiées, mais toujours sur le même principe : déposer des couches successives de matière, solidifiées au fur et à mesure par apport de lumière ou de chaleur. À l’instar, dans le jargon technique, du dépôt de fil plastique par extrusion ou de la fusion et du frittage sélectifs par laser. Les matériaux aussi se sont diversifiés : il est désormais possible d’imprimer de nombreux métaux, du verre, de la céramique, du graphène, et même du chocolat... Aujourd’hui, c’est au tour des cellules, grâce aux progrès de la bio-ingénierie. Ce matériau vivant exige cependant des procédés adaptés à son extrême fragilité. Trois techniques de bio-impression sont actuellement à l’étude : l’impression assistée par laser, qui consiste à utiliser un laser pour déposer des micro-gouttelettes contenant de 1 à 50 cellules ; la micro-extrusion, consistant à utiliser des seringues comme buses d’impression. Et enfin le jet d’encre, inspiré des imprimantes domestiques, qui pulvérise une solution dite « bio-encre », contenant des cellules.
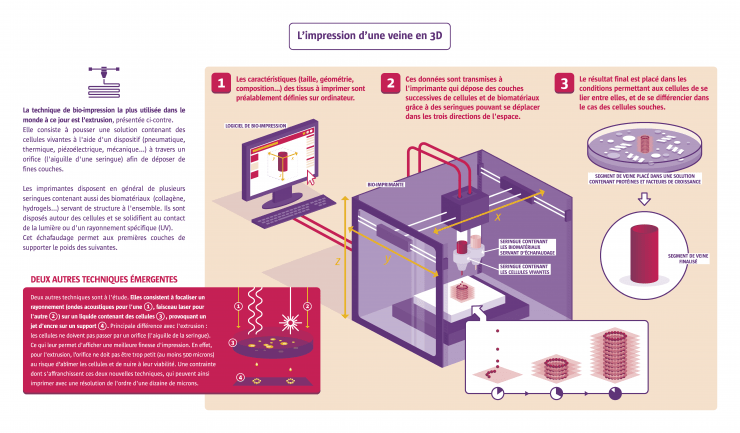
L'impression d'une veine en 3D
Une peau de rechange
En janvier 2017, une équipe de l’université Carlos III de Madrid a annoncé dans la revue Biofabrication être parvenue à créer une peau dont la structure ressemble à celle de la peau humaine, avec un épiderme pour la protection contre les agressions extérieures et un derme composé de fibroblastes, ces cellules lui conférant à la fois résistance et élasticité. Elle ne dispose en revanche ni de poils, ni de pigments. Il a fallu moins de 35 minutes aux chercheurs espagnols pour obtenir 100 cm2 de peau imprimée en 3D, alors que les grands brûlés attendent parfois plusieurs semaines pour qu’une peau soit confectionnée in vitro avec les techniques habituelles de culture cellulaire.
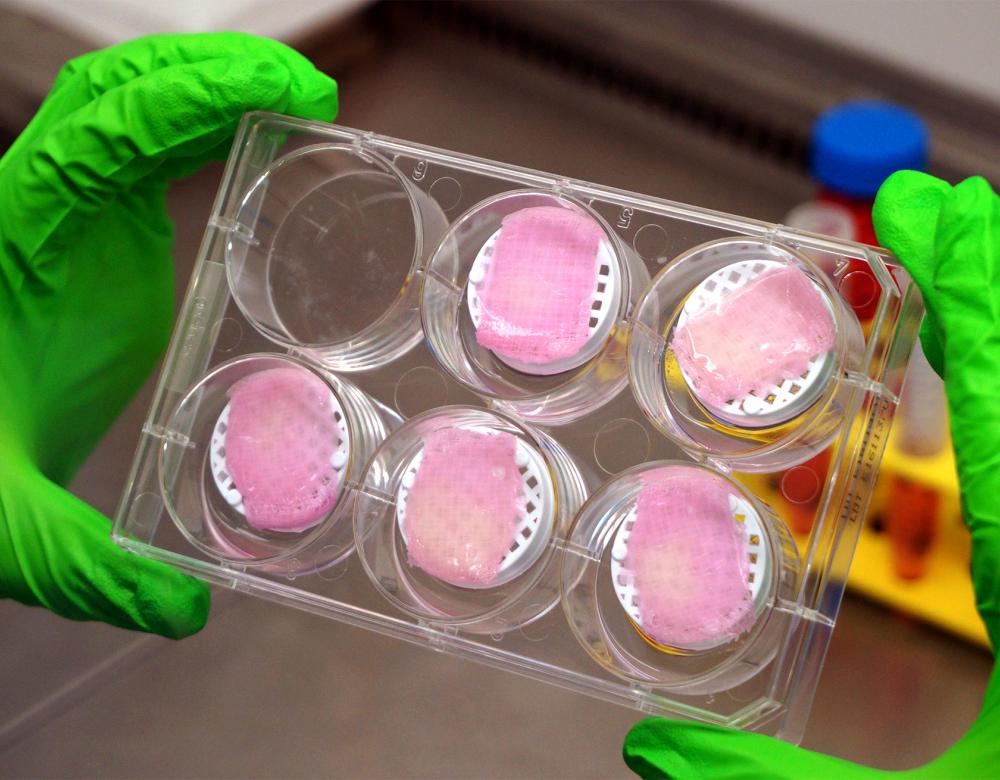
Des cellules aux super pouvoirs
Les cellules souches sont des candidates idéales pour l’impression de tissus biologiques en 3D.
Découvertes chez l’humain en 1998, les cellules souches sont dites « indifférenciées pluripotentes », ce qui signifie qu’elles possèdent la propriété unique de pouvoir se transformer en n’importe quelle cellule présente dans l’organisme : peau, muscle, sang, cartilage… Bref, une espèce de cellule généraliste capable de se spécialiser selon les besoins de l’organisme, permettant à ce dernier de se régénérer tout au long de la vie. C’est ce mécanisme qui permet, par exemple, à la peau de se renouveler en permanence. Une propriété qui rend les cellules souches particulièrement intéressantes pour la thérapie cellulaire, discipline visant à guérir un organe malade par l’apport de cellules saines. Et qui en fait des candidates idéales pour la création d’organes par bio-impression. Le principe : il suffit de les prélever (elles sont présentes dans l’embryon et dans la quasi-totalité des organes adultes), les cultiver en laboratoire et les pousser ensuite à se différencier dans les types de cellules souhaitées. C’est pourquoi on qualifie parfois la bio-impression d’impression « 4D », pour signifier qu’une dimension supplémentaire, le temps – nécessaire à la maturation des cellules –, joue un rôle important dans l’utilisation du vivant.
Bio-imprimantes : une technologie encore jeune
Ce modèle de bio-imprimante, baptisé Novogen, a été mis au point par l’entreprise de biotechnologie californienne Organovo. Basée sur la technique d’extrusion, elle utilise quatre seringues contenant les différents types de cellules et de biomatériaux. Sa première version, mise en point en 2009, n’en comportait que deux. Le premier brevet au monde concernant les techniques de bio-impression a été déposé en 2003 par Thomas Boland, un bio-ingénieur de l’université de Clemson (Caroline du Sud). Il portait sur l’adaptation de la technique d’impression par jet d’encre (celle utilisée par des imprimantes grand public) pour la rendre compatible avec une bio-encre contenant des cellules vivantes.
Une course à la précision
Les organes sont irrigués par un réseau vasculaire complexe et délicat l’un des principaux défis pour les bio-imprimantes.
L’avènement de la bio-impression d’organes est jusqu’ici limitée par une contrainte critique : la résolution, c’est-à-dire la finesse et la précision avec lesquelles il est possible de fabriquer un organe. Or, la survie des tissus organiques en dépend. En effet, ces derniers sont traversés par des vaisseaux sanguins qui participent activement à leur fonctionnement. Une partie de ce réseau se compose de minuscules vaisseaux, appelés capillaires, d’un diamètre d’environ 10 microns (millièmes de millimètre). Jusqu’à présent, les bio-imprimantes n’étaient pas capables de former des vaisseaux sanguins d’un diamètre inférieur à 100 micromètres. Mais cette frontière est en passe d’être franchie. Apparue il y a deux ans, l’impression assistée par laser parvient à une résolution proche de la taille d’une cellule (5 microns). Autre exemple : des travaux publiés en février 2016 dans la revue Nature Biotechnology par l’université Wake Forest (Caroline du Nord, États-Unis) font état d’une nouvelle technique de bio-impression présentant elle aussi une résolution de l’ordre de 5 microns. Son secret : l’utilisation de quatre buses, deux pour les cellules vivantes et deux pour des hydrogels polymères. Les chercheurs ont ainsi pu fabriquer un fragment de mandibule, un fragment d’os crânien, un cartilage d’oreille et un échantillon de muscle, qui se sont tous avérés viables pendant quelques semaines.

Appel à la modération
Pour Fabien Guillemot, chargé de recherche Inserm et président de l’entreprise Poietis, on est encore loin de la fabrication d’organes complexes (cœur, foie, rein) par impression 3D.
Surmonter une série d’obstacles
Un premier pas a été franchi avec l’os, la peau ou le muscle. Mais on est encore loin d’imprimer des organes fonctionnels.
L’impression 3D d’échantillons d’organes simples, comme la peau, l’os, le cartilage, le muscle ou les veines est déjà une réalité au laboratoire. Mais il s’agit encore d’objets expérimentaux pas parfaitement « biofidèles » et donc inutilisables comme greffons en médecine. Concernant des organes plus complexes (cœur, foie ou rein) il faudra encore plus de temps avant d’espérer les imprimer à un stade fonctionnel. La première difficulté, c’est que ces organes combinent plusieurs types de tissus biologiques (musculaire, nerveux, épithélial...). Il faudra donc imprimer finement de nombreux types de cellules au sein d’un même organe. Autre défi : pour que l’organe soit viable, il faut qu’il soit structuré et doté d’un réseau sanguin très complexe qui permette de l’alimenter, ce que les imprimantes ne savent pas encore faire. Enfin, pour les greffes, il faut que l’organe bio-imprimé puisse être implanté chez le patient et toléré. Autant de défis qui restent à résoudre avant de pouvoir espérer disposer d’organes plug and play, prêts à greffer. Mais là encore, les progrès sont permanents : en mai 2017, une équipe de l’université Northwestern de Chicago a annoncé dans la revue Nature Communications être parvenue à rendre fertiles des souris initialement stériles grâce à une transplantation d’ovaires en partie bio-imprimés. Elles ont donné naissance à des souriceaux en parfaite santé...
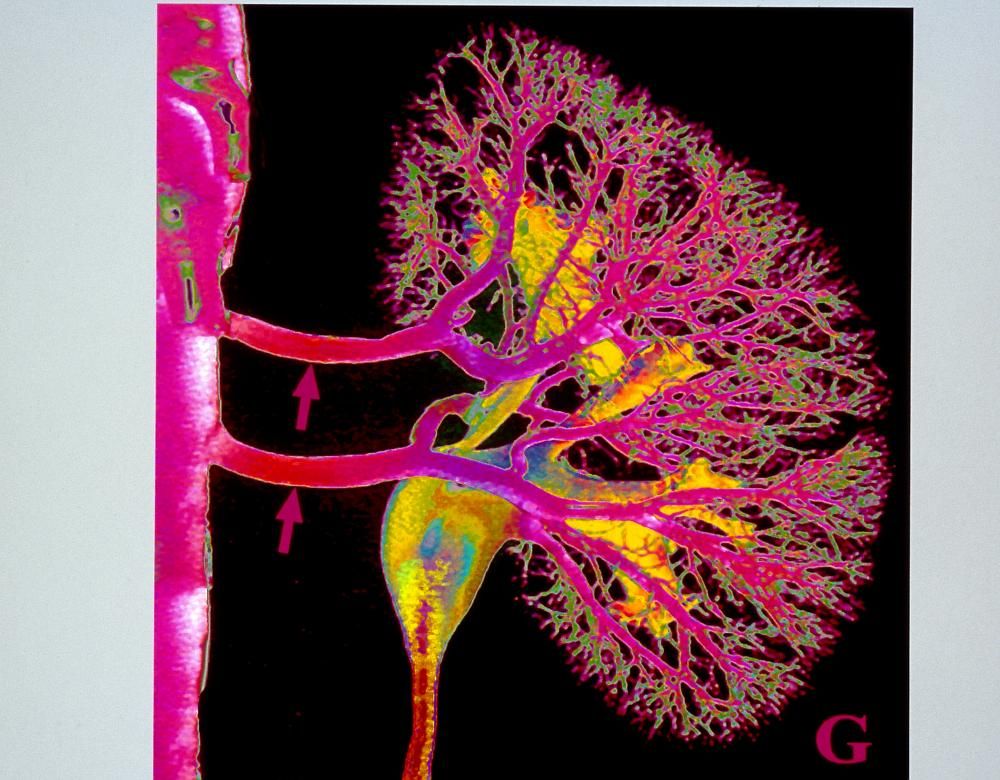
Le défi des vaisseaux sanguins
Doté d’une vascularisation riche et diversifiée et d’une importante innervation, le rein illustre parfaitement les défis à relever pour pouvoir, un jour, imprimer en 3D ce type d’organe complexe. Cette vascularisation a notamment pour rôle de filtrer jusqu’à 150 litres de sang par jour. Le rein est aussi chargé de sécréter l’urine pour l’élimination des déchets azotés. Et participe activement à la régulation de la pression artérielle, à la fabrication des globules rouges et à la minéralisation osseuse. C’est de loin l’organe le plus transplanté (61,4 % des greffes effectuées en France en 2016) et pour lequel la bio-impression représente donc la plus forte attente.
Une approche pluridisciplinaire
De la biologie cellulaire à l’informatique logicielle en passant par la mécanique…
La bio-impression d’organes fait appel à diverses expertises. L’impression 3D de cellules vivantes est un axe de recherche en plein essor qui bénéficie des progrès en cours dans de nombreuses disciplines scientifiques. C’est évidemment le cas de la biologie, pour le prélèvement des cellules, leur culture, la différenciation des cellules souches dans le tissu ou l’organe souhaité, le développement de bio-encres utilisées dans les imprimantes… Mais aussi de l’ingénierie tissulaire, une discipline dédiée à l’étude des structures des tissus biologiques. L’une des principales difficultés de la bio-impression est en effet d’obtenir un organe qui ne s’affaisse pas sur lui-même, d’où de nombreuses recherches sur la mise au point d’« échafaudages » servant à structurer les cellules. Il est aussi question de biomatériaux (les matériaux destinés à interagir avec un système biologique), de mécanique (pour la mise au point des composants des imprimantes), d’optique (pour la technique d’impression assistée par laser, notamment), d’informatique logicielle (pour la conception numérique de la structure de l’organe en 3D avant sa fabrication)… Certaines de ces disciplines ont commencé à converger il y a une dizaine d’années avec l’essor des prothèses médicales imprimées en 3D.