La révolution de l’ARN messager
Le prix Nobel de médecine 2023 a été décerné à deux pionniers de l’ARN messager. Popularisée par les vaccins anti-Covid, cette technologie pourrait bouleverser de larges pans de la médecine : prise en charge des maladies infectieuses et cardiovasculaires, régénération d’organes, lutte contre les pathologies cancéreuses, stratégies vaccinales etc. Voici comment.
Lise Barnéoud - Publié le , mis à jour le
Longtemps dénigré, l’ARN messager a subitement occupé le devant de la scène grâce aux vaccins anti-Covid. Cette nouvelle technique médicale pourrait non seulement prévenir d’autres maladies infectieuses mais aussi traiter le cancer, régénérer les os, réparer des vaisseaux sanguins et même lutter contre l’antibiorésistance… Les attentes sont immenses. Mais il faut savoir rester prudent : bien des obstacles restent encore à franchir !

Des racines lointaines… et françaises !
En 1961, deux chercheurs français, François Jacob et François Gros (décédé le 18 février 2022 à l’âge de 96 ans), démontrent la présence et le rôle de l’ARNm dans les cellules. Jusqu’alors, son existence n’était qu’une hypothèse, formulée notamment par un autre chercheur français : Jacques Monod.
Toutefois, les premiers essais d’utilisation de l’ARNm dans un but médical ne débuteront que dans les années 1990. La faute à l’ADN, qui attire toute la lumière et les crédits de recherche qui vont avec, mais aussi à l’instabilité de l’ARNm au sein des cellules.
L’ARNm, c’est quoi ?
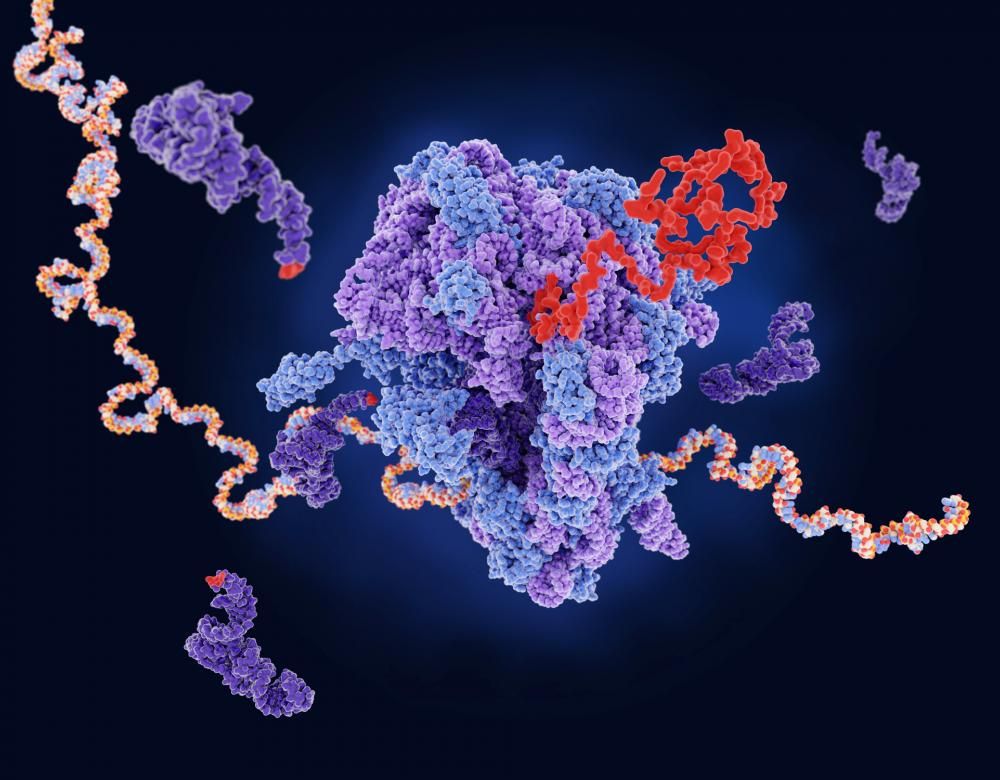
Si l’ADN est la « partition du vivant », les ARNm en sont assurément les chefs d’orchestre. En sortant du noyau de la cellule, ce sont eux qui transmettent les plans de fabrication des protéines aux ribosomes. Ces derniers assemblent alors, selon leurs instructions, les différents acides aminés créant ainsi les longs colliers protéiques nécessaires au bon fonctionnement de notre corps. Contrairement à l’ADN, les ARNm ne survivent que quelques instants dans la cellule et ne peuvent pas retourner à l’intérieur du noyau. Dans ces conditions, ils ne peuvent pas faire de nous des OGM, comme on l’entend parfois.
Les prémices d’une révolution
Passé de l’ombre à la lumière, l’ARN messager suscite aujourd’hui de nombreux espoirs.
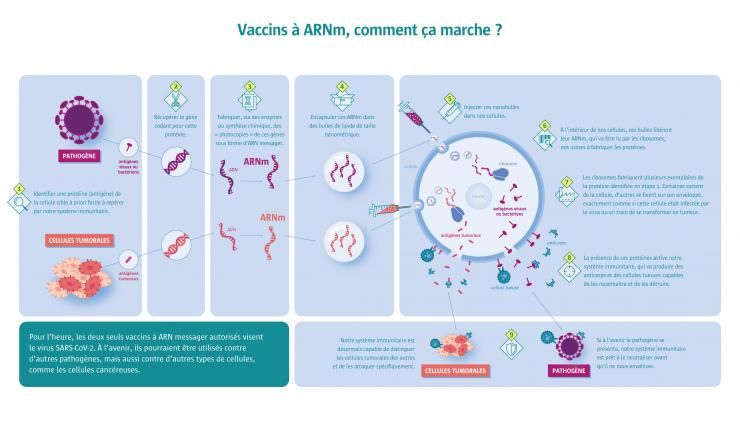
Depuis les vaccins anti-Covid, un nouvel acronyme a fait irruption dans notre langage courant : ARNm, pour acide ribonucléique messager. Quatre lettres « qui vont tout changer », estime Steve Pascolo, chercheur à l’hôpital universitaire de Zurich. L’ARNm est chargé de transmettre une copie des plans de fabrication des protéines (ces grosses molécules qui assurent toutes sortes de fonctions au sein de nos cellules et de notre organisme) aux ribosomes, nos « usines cellulaires ».
Jusqu’alors parent pauvre de la biologie, l’ARNm éclipse désormais son grand frère, l’ADN, l’acide désoxyribonucléique, qui détient le plan original de toutes les protéines qui nous composent. Dans les laboratoires, les projets de recherche visant à utiliser l’ARNm se multiplient et visent non seulement les maladies infectieuses (sida, paludisme, grippe, zika), mais aussi les maladies cardiovasculaires, les cancers, les maladies génétiques ou encore les allergies.
Actuellement, plusieurs centaines d’essais cliniques impliquant l’ARN sont en cours, et leur nombre est en forte augmentation, la plupart se déroulant aux États-Unis et en Europe. « Le Covid a finalement représenté une bonne opportunité pour démontrer l’immense intérêt de cette nouvelle approche, affirme Chantal Pichon, du Centre de biophysique moléculaire du CNRS, à Orléans, dont les demandes de subvention pour ses recherches sur l’ARNm se voient désormais beaucoup plus facilement acceptées. Certains collègues sont encore dubitatifs, mais pour ma part, je m’attends à vivre une véritable révolution dans la médecine ».
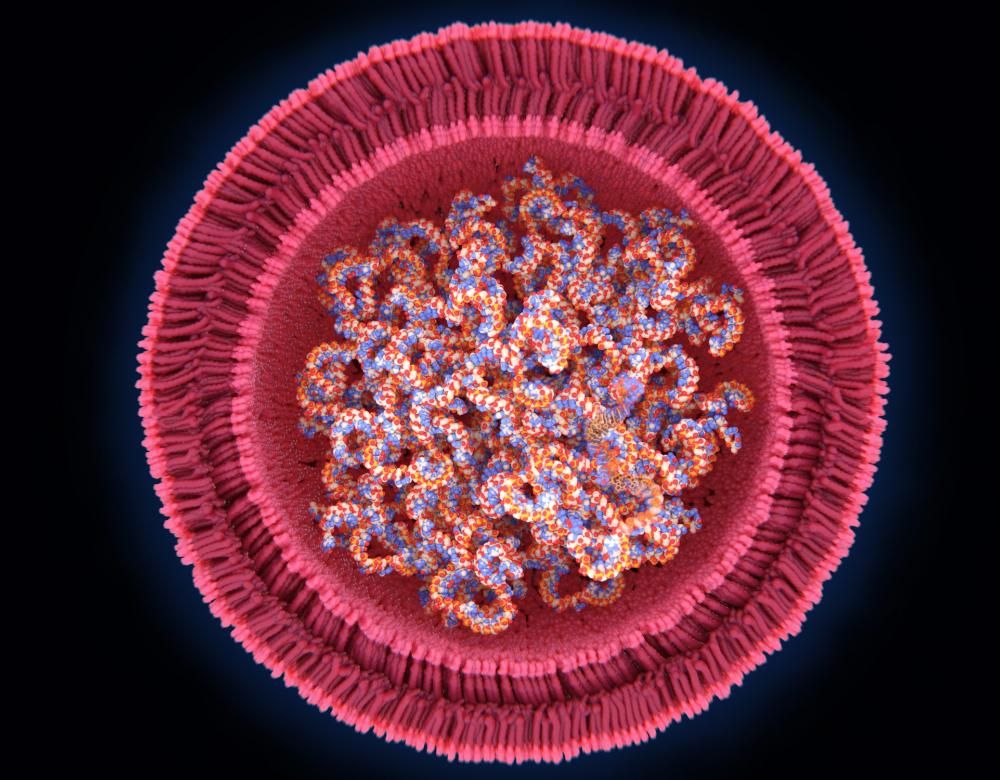
Des bulles de lipides comme emballage
Pour que l’ARNm puisse être utilisé comme traitement, il lui faut un empaquetage résistant aux enzymes – ces dernières identifient en effet les ARN en provenance de l’extérieur comme des virus à détruire. Mais cet emballage doit également pouvoir s’ouvrir sans outil particulier à l’intérieur des cellules. Tel est le rôle des nanoparticules de lipides, mises au point dans les années 1980. Selon leurs caractéristiques, certains « paquets » ne s’ouvrent que dans certains tissus alors que d’autres relarguent leur contenu plus facilement. Certains permettent d’activer le système immunitaire alors que d’autres, dits immuno-silencieux, évitent de le réveiller.
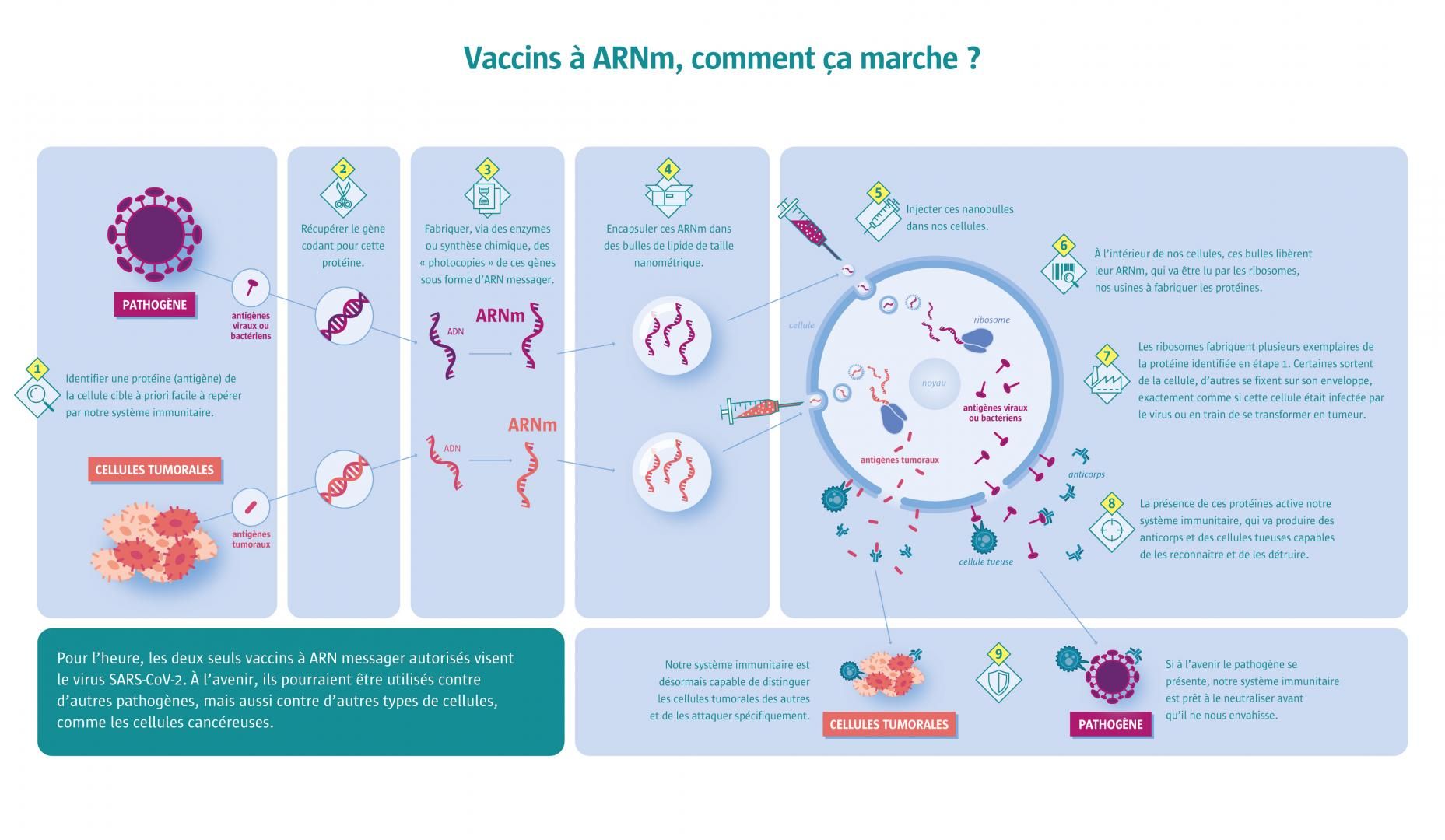
Vaccins à ARNm, comment ça marche ?
Vers un vaccin universel contre la grippe ?
Inspirée de la conception des vaccins à ARN messager (ARNm) contre la COVID-19, une nouvelle stratégie pourrait servir de base à ce qui fait aujourd’hui figure de panacée dans la lutte contre la grippe : un vaccin universel. En effet, il est très difficile de prédire, d’une année à l’autre, quelle souche grippale entraînera la prochaine épidémie. À ce jour, 20 lignées de virus grippaux A et B ont été identifiées, chacune contenant de nombreuses souches ! Si bien que les vaccins actuels, composés de quatre antigènes viraux de la grippe, offrent peu de protection au-delà des souches virales ciblées.
Or une équipe américaine est parvenue à développer un vaccin à base de nanoparticules lipidiques d’ARNm, comportant des antigènes des 20 lignées de virus grippaux répertoriées à ce jour. Chez les souris et les furets, ces vaccins ont produit des niveaux élevés d’anticorps qui pourraient les protéger contre les symptômes de la maladie après une infection par une grande variété de souches de grippe, rapporte l’équipe dans une étude de Science parue en novembre 2022. En outre, les niveaux d’anticorps demeuraient stables, pour la plupart, quatre mois après la vaccination.
Au lieu d’utiliser un petit nombre d’antigènes partagés par les sous-types de la grippe, cette nouvelle approche inclut des antigènes spécifiques à chaque sous-type. Elle consiste à encapsuler dans des nanoparticules 20 ARNm différents, chacun codant pour une protéine grippale impliquée dans la pénétration du virus dans la cellule. Une première étude fructueuse sur modèles animaux, qui ouvre la voie à un vaccin antigrippal universel.
Une molécule fragile ?
L’un des inconvénients des deux vaccins ARN actuels réside dans leur mode de conservation : l’ultra-froid. Une température dictée non pas par la molécule d’ARN en elle-même, extrêmement stable dès lors qu’aucune enzyme n’est présente, mais par les nanoparticules de lipides, beaucoup moins stables. L’ARN est en effet la seule molécule biologique que l’on peut chauffer, lyophiliser, congeler, sans jamais la désactiver.
Tout soigner ?
Aurait-on découvert avec l’ARNm le graal de la médecine ? Pas encore…
« En théorie, vous pouvez tout traiter avec l’ARN », s’enthousiasme le spécialiste Steve Pascolo. De fait, la plupart des maladies découlent d’un dysfonctionnement de protéines : soit le corps n’en produit pas ou pas assez, soit il en produit trop, soit encore les protéines qu’il fabrique sont altérées. Or, avec l’ARNm et les autres types d’ARN (comme les ARN interférents), il est possible d’activer ou au contraire de bloquer la production d’une protéine, ou encore de faire produire par nos cellules des protéines absentes de notre répertoire, ou défaillantes.
À terme, il est envisagé de combiner ces différentes fonctions : éteindre la production d’une protéine et en faire fabriquer une nouvelle par exemple. En outre, en jouant sur l’emballage et la nature de ces ARN, on peut activer le système immunitaire, ce qui est recherché dans le cas des vaccins. Mais dans le cas des thérapies dites régénératrices, où l’on apporte par exemple des facteurs de croissance pour réparer des vaisseaux sanguins ou des os, on veut au contraire éviter que nos cellules immunitaires ne repèrent puis ne s’attaquent à ces nouvelles protéines. Dans ce cas, on fabrique des ARN dits immuno-silencieux, capables de passer inaperçus. L’un des grands avantages de cette approche, c’est que contrairement aux autres types de médicaments, ici ce sont nos cellules qui fabriquent les molécules thérapeutiques.
Mais il reste encore plusieurs challenges. Dans certaines situations, il faut une production durable de protéines, ce qui nécessite pour l’heure des rappels incessants. Dans d’autres cas, on recherche une réponse dans certains organes uniquement, or « il est encore compliqué de cibler des organes précis », explique Chantal Pichon, biologiste au CNRS.
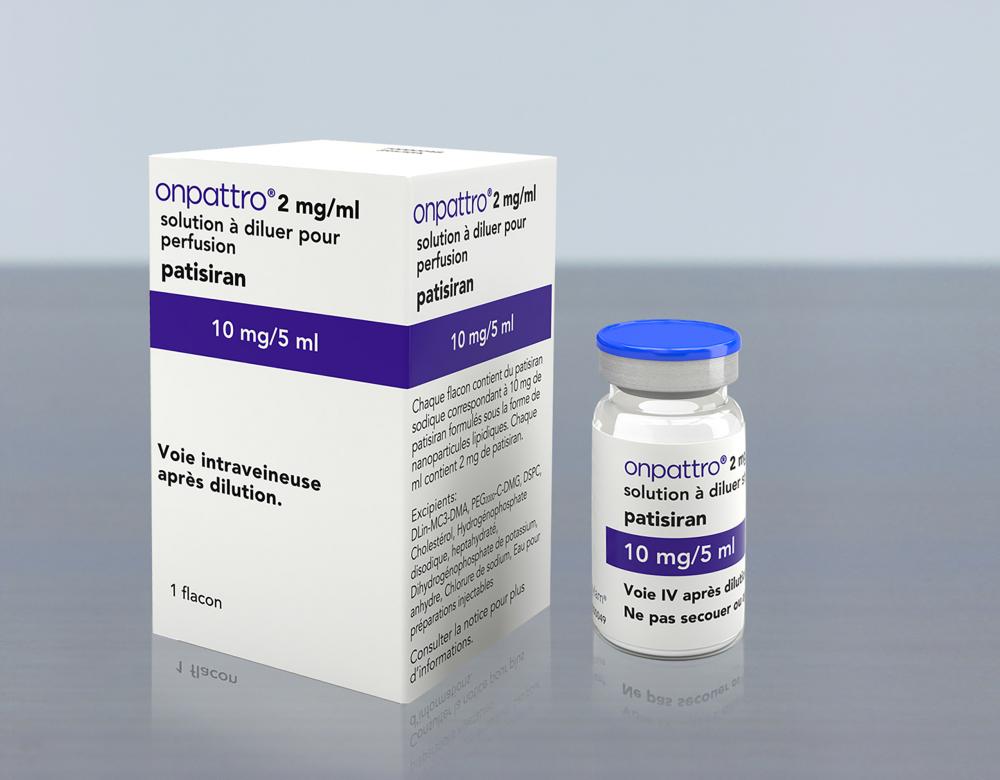
Onpattro, le tout premier traitement à base d’ARN
Contrairement à ce que l’on croit, les vaccins anti-Covid ne sont pas les premiers traitements à base d’ARN. En 2018, l’Agence européenne du médicament donnait son feu vert à la mise sur le marché d’un médicament nommé Onpattro (Patisiran), pour le traitement d’une maladie rare gravissime, l’amylose héréditaire. Ce médicament ne contient pas un ARN messager mais un ARN interférent (ARNi) : en permettant de modifier le niveau de production d’une protéine dans l’organisme, ces petits ARN possèdent eux aussi un potentiel thérapeutique majeur.
Un virage en cancérologie
L’ARNm pourrait s’avérer une arme idéale contre les cancers.
Puisqu’une cellule devient cancéreuse suite à des mutations spécifiques à chaque individu, il est théoriquement possible de fabriquer des ARNm porteurs de ces mutations afin d’apprendre à nos cellules immunitaires comment identifier puis attaquer ces cellules mutées. « C’est un moyen pour nous d’essayer d’obtenir les bonnes cellules immunitaires au bon endroit au bon moment pour attaquer le cancer », résume Julie Bauman, du Centre de cancer de l’université d’Arizona, qui a mené un essai prometteur en 2020. Certains patients atteints d’un cancer de la tête et du cou avaient alors vu leur tumeur disparaître après une dizaine d’injections, en l’espace d’un an.
La firme pharmaceutique allemande BioNTech mène actuellement 12 essais cliniques avec l’ARNm sur différents types de cancer, dont quatre en phase 2. Toutefois, ce nouveau type de vaccin ne fonctionne pas chez tout le monde. Par exemple, lorsque le cancer s’est déjà fortement propagé, le système immunitaire est trop affaibli pour répondre à une telle stimulation. Dans ce cas, une autre approche existe : une thérapie à base d’ARN. Cette fois, les ARNm portent les instructions pour fabriquer un cocktail de protéines dites anti-tumorales, comme, par exemple, les cytokines. Une fois injectés dans la tumeur, ils déclenchent une production locale de ces protéines anti-cancer. « C’est beaucoup plus facile et efficace de faire fabriquer ces protéines anti-cancer par le corps plutôt qu’en laboratoire », remarque Steve Pascolo. À l’avenir, on pourrait combiner ces deux approches : d’abord la thérapie si le patient souffre d’un cancer avancé, puis la vaccination pour éviter les récidives.
Moderna et Merck MSD sont probablement sur le point de réaliser la prouesse d’un traitement de ce type. En décembre 2022, les deux partenaires annoncent que leur vaccin à ARN messager réduit de 44 % le taux de récidive et de mortalité de patients présentant des mélanomes cutanés à un stade avancé (stades 3 ou 4). Ce vaccin thérapeutique vient d’achever ses tests de phase 2, débutés en 2019 et conduits sur 157 participants aux Etats-Unis et en Australie. Ayant établi cette « preuve de concept », le tandem Moderna/Merck MSD espère commencer les tests de phase 3 en 2023 et les étendre à l’Europe. Une nouvelle étape qui durera au moins trois ans, le temps d’évaluer les effets du traitement sur la durée.
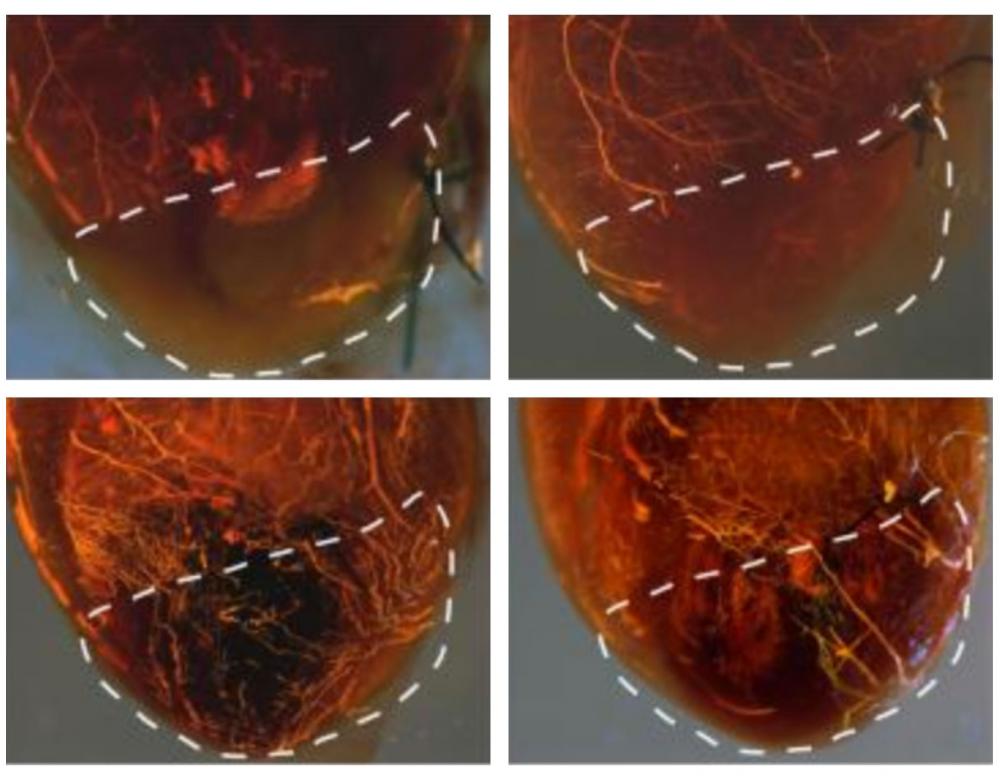
Reconstruire des organes grâce à l’ARNm
Autre prouesse de l’ARN : faire produire au sein d’un tissu les protéines nécessaires à sa régénération, bien souvent des facteurs de croissance. Chez l’animal, des essais époustouflants ont déjà été menés, notamment pour réparer des os, ou ici, pour réparer des vaisseaux sanguins endommagés par un infarctus. Des essais cliniques chez l’Homme sont en cours.
Lutter contre l’antibiorésistance
Puisque la résistance de certaines bactéries à nos antibiotiques est liée à la surexpression de certaines de leurs protéines, des chercheurs de l’Inserm ont eu l’idée d’utiliser des petits ARN appelés oligonucléotides, capables de bloquer l’ARN messager et donc de stopper cette surproduction. Une approche alternative aux antibiotiques, encore à l’état de recherche fondamentale, mais qui représente un immense espoir face aux centaines de milliers de décès annuels liées aux infections bactériennes résistantes.
Des succès… et des déceptions
En introduisant, via un spray inhalé, des ARN messager codant pour une protéine altérée chez les personnes atteintes de mucoviscidose (protéine CFTR), les chercheurs espéraient faire produire directement par les cellules pulmonaires le mucus protecteur des bronches. En 2019, les premiers résultats d’un essai clinique de phase 1 s’avéraient prometteurs. Mais ils semblent aujourd’hui temporaires : même en augmentant les doses et le nombre d’inhalations, la fonction pulmonaire ne progresse pas significativement chez les patients traités…