Microbiote : une révolution médicale
Les micro-organismes qui vivent en symbiose avec nous forment un écosystème dont on commence à entrevoir l’importance. Leur étude ouvre l’espoir de nouveaux types de traitements.
Textes de Lise Barnéoud - Publié le
Pas moins de 40 mille milliards de micro-organismes habitent notre corps ! La majeure partie se trouve dans notre gros intestin. À l’échelle microscopique, nous ne sommes qu’à moitié humain : pour une cellule humaine, nous hébergeons 1,3 cellule étrangère. De plus en plus, les chercheurs réalisent à quel point ces microbes nous gouvernent. Ils jouent un rôle central dans notre digestion, mais aussi dans nos maladies, notre immunité et même nos comportements. Une découverte importante émerge de l’ensemble de ces récents travaux : plus nous abritons d’espèces différentes de micro-organismes, mieux nous nous portons. Or, à cause de nos modes de vie dans les pays riches, notre microscopique biodiversité serait en train de s’appauvrir, ce qui pourrait favoriser la survenue de certaines maladies telles que l’obésité ou le diabète. Une nouvelle médecine est en train de naître, où l’objectif ne serait plus de nous débarrasser de nos germes, mais d’entretenir notre diversité microbienne.
L’intestin, un concentré de micro-organismes
La plupart des études porte sur notre communauté microbienne intestinale, la plus riche du corps humain. Là, des milliards de micro-organismes s’entassent sur les parois tout en relief du tube digestif. Ils décomposent les restes de nourriture, alimentent nos intestins en énergie, fabriquent des vitamines, éliminent les toxines, construisent notre système immunitaire, évitent la prolifération de bactéries pathogènes. Mais ils produisent aussi quantité de molécules qui traversent la muqueuse intestinale et influencent ainsi l’ensemble de notre corps, dont notre cerveau !
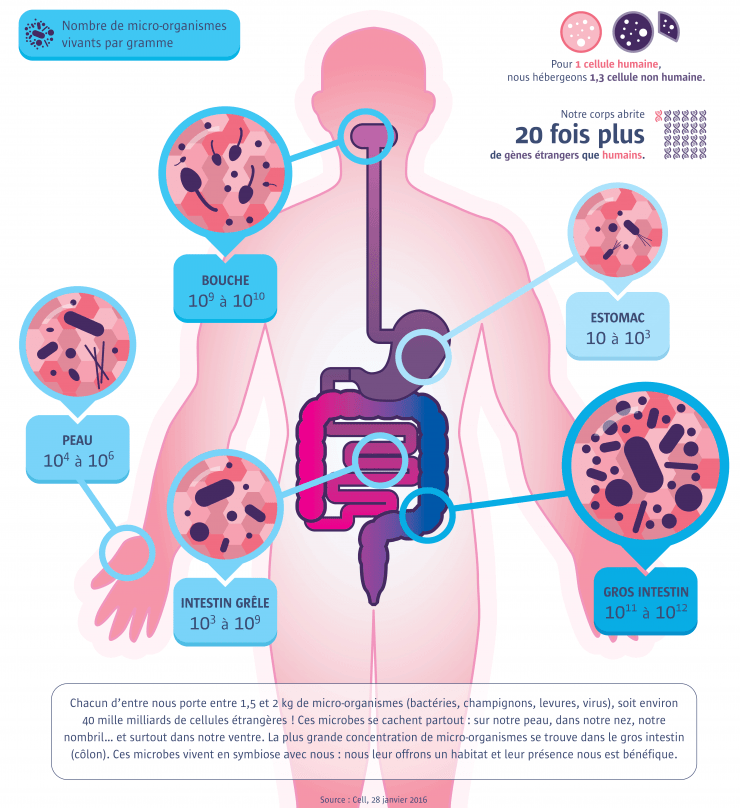
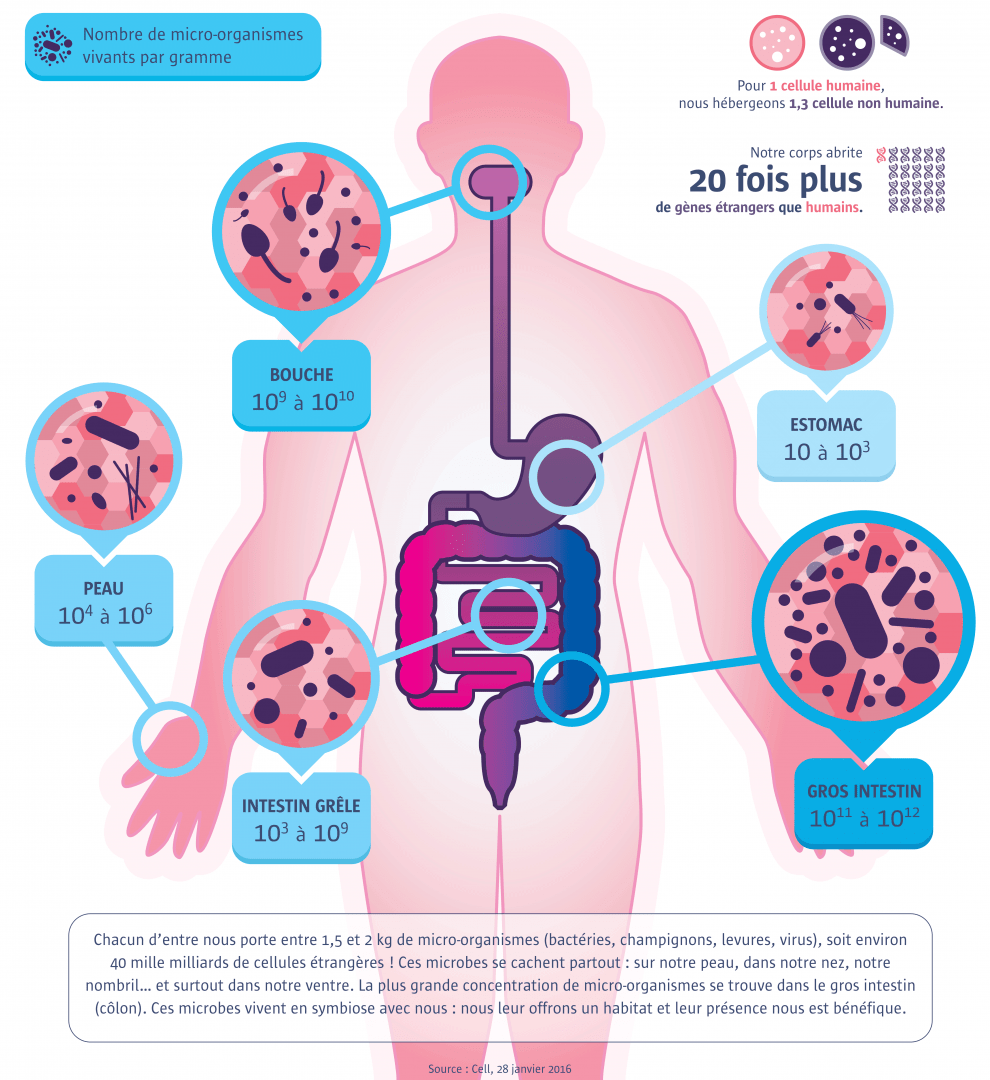
Le corps microbien
Plus de 50 % de cellules étrangères !
La moitié de nos cellules ne sont pas humaines. Notre corps abrite des micro-organismes, dont la composition diffère d’un individu à l’autre.
Dans le ventre maternel, le fœtus se développe dans un environnement quasiment stérile : rares sont les micro-organismes qui traversent la barrière de l’utérus. En revanche, dès que la poche des eaux se rompt, bactéries et autres microbes colonisent le bébé. Ils sont essentiellement issus du vagin de la mère, mais aussi de sa peau ou de celle des sages-femmes. C’est le début d’une cohabitation qui ne prendra fin qu’à la mort de l’individu. Durant les premières années de vie, la biodiversité de cette communauté microbienne, appelée microbiote, s’enrichit. Dès l’âge de trois ans, l’enfant dispose d’un microbiote mature, avec un niveau de diversité identique à celui des adultes, qui restera relativement stable tout au long de la vie. De 100 % de cellules humaines in utero, notre corps passe à plus de 50 % de cellules étrangères ! Ce microbiote, qui vit en symbiose avec nous, nous est personnel. Certains micro-organismes peuvent se retrouver en plus ou moins grande quantité selon les individus, voire être totalement absents. Divers facteurs influencent, par exemple, la composition de la flore intestinale : usage de médicaments, habitudes alimentaires, consommation d’alcool, durée de sommeil, vitesse du transit intestinal… Néanmoins, d’après deux études publiées dans la revue Science en avril 2016 et conduites auprès de 4 000 personnes, ces facteurs n’expliquent que 20 % des différences de microbiote entre individus. D’autres travaux doivent encore être menés pour mieux comprendre ce qui détermine notre flore intestinale.
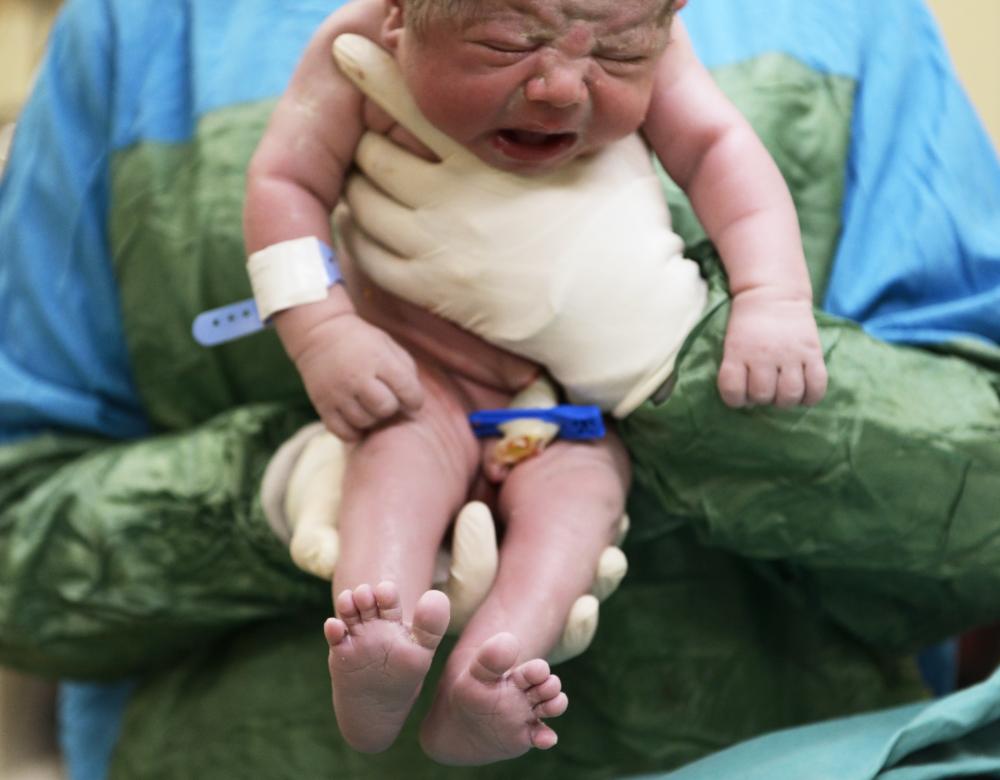
Gare à la césarienne !
Une pratique se développe de plus en plus pour les enfants nés par césarienne : l’ensemencement vaginal, autrement dit l’imprégnation du nouveau-né avec les sécrétions vaginales de la mère (à l’aide d’une bande de gaze) dans l’objectif de restaurer une colonisation « normale » du microbiote de l’enfant. De fait, des études épidémiologiques semblent indiquer que les naissances par césarienne augmentent le risque d’obésité, d’asthme et de maladies auto-immunes, des pathologies également associées à des déséquilibres du microbiote. Toutefois, cette pratique présente le risque de transmettre des agents pathogènes, comme le streptocoque B.

Retrouver de la biodiversité !
Joël Doré, directeur de recherche à l’Inra, met en garde contre la perte de biodiversité de notre microbiote intestinal.
Durée : 2 min
Un véritable écosystème
Grâce à la métagénomique, on a désormais accès à l’ADN des micro-organismes présents dans notre microbiote. Avec, à la clé, des millions de gènes découverts !
Si l’on parvient à cultiver certaines espèces de bactéries à partir de nos selles, la plupart nous échappent car elles ne sont pas cultivables au laboratoire. De fait, notre microbiote était encore une terra incognita il y a dix ans. Heureusement, une nouvelle technique a vu le jour : la métagénomique. Son principe ? Séquencer directement l’ADN des micro-organismes présents dans notre microbiote à partir de différents échantillons du corps (bouche, peau, gorge, intestins, selles…). Résultat : plus de 10 millions de gènes bactériens ont été découverts dans les selles de plusieurs milliers d’individus ! Ce séquençage massif a été rendu possible grâce à l’avènement de séquenceurs haut débit à la puissance incomparable. Des modèles mathématiques ont ensuite permis aux chercheurs de « reconstruire », à partir des gènes, les génomes de ces bactéries inconnues. Un nouveau mot a fait son apparition : microbiome, qui désigne l’ensemble des génomes microbiens présents dans le microbiote. Pour la flore intestinale, 700 génomes bactériens sont désormais connus. Chacun d’entre nous abrite environ 500 espèces de bactéries dans son intestin. Un tiers d’entre elles sont partagées par un grand nombre de personnes, mais deux tiers sont plus rares, voire propres à chaque individu. De plus en plus, les chercheurs comparent ce microbiote à un écosystème : comme dans la nature, plus le nombre d’espèces est important, mieux l’écosystème fonctionne et résiste aux agressions extérieures. Ainsi, les personnes malades présentent bien souvent une diversité microbienne appauvrie.
Le monde microbiotique
Si les bactéries sont les plus étudiées, d’autres micro-organismes cohabitent avec elles. Les champignons et les levures (particulièrement les espèces Candida et Saccharomyces) pourraient jouer un rôle important dans la survenue des maladies chroniques de l’intestin. On trouve également des archées (organismes unicellulaires regroupés dans un règne à part, distinct des bactéries) et de très nombreux virus, dont la plupart seraient des bactériophages, autrement dit des virus qui infectent les bactéries. Un monde peu connu qui reste encore à explorer…
Vers une nouvelle médecine ?
La découverte du rôle de la flore intestinale dans le développement de certaines maladies conduit les chercheurs à tester de nouvelles thérapies.
Les études scientifiques explorant notre flore intestinale se sont multipliées ces dernières années. Avec, à la clé, des découvertes étonnantes : les milliards de bactéries qui logent dans l’intestin ne sont pas impliquées que dans la digestion. Elles jouent aussi un rôle dans le fonctionnement des systèmes immunitaire et nerveux. Voilà pourquoi on suspecte aujourd’hui l’implication de déséquilibres de la flore intestinale dans toute une série de maladies : inflammation chronique de l’intestin, obésité, diabète, allergies, polyarthrite rhumatoïde, cancer colorectal, dépression, autisme… Néanmoins, un lien de causalité n’a été démontré que pour des pathologies digestives (troubles du transit intestinal, ballonnements…) et certaines maladies métaboliques (comme l’obésité). On ne comprend pas encore comment la flore intestinale intervient dans les autres maladies. Pour autant, un grand nombre d’experts estiment que ces découvertes ouvrent la voie à une nouvelle médecine, capable d’agir sur la flore intestinale à titre préventif (en entretenant un microbiote diversifié et riche) comme à titre curatif (en manipulant directement son microbiote). Certaines thérapies sont d’ailleurs déjà utilisées ou à l’essai, comme la transplantation de matières fécales ou la mise au point de bactéries génétiquement modifiées pour produire, par exemple, des molécules anti-inflammatoires dans l’intestin. Autre découverte intéressante : la réponse à certains médicaments (chimiothérapies et immunothérapies) varie en fonction de la composition de notre microbiote. À l’avenir, il se pourrait bien que le séquençage systématique de nos microbes vienne compléter avantageusement le séquençage de notre ADN.
Inoculation de selles !
Comment rétablir la flore intestinale d’une personne malade ? En lui injectant des échantillons de selles provenant d’une personne saine ! Cette technique dite de « transplantation fécale » est actuellement utilisée en cas de grave infection intestinale due à la bactérie Clostridium difficile (ou CD), résistante à tous les antibiotiques. Sur plus de 500 cas publiés, le taux de succès s’élève à près de 90 %. En 2015, l’une des premières banques de selles américaine, Openbiome, a mis sur le marché des gélules à base de matière fécale. Coût du traitement : 635 dollars. Des essais sont en cours pour d’autres maladies comme les troubles fonctionnels de l’intestin ou le diabète de type 2.
Sans microbiote, pas d’immunité efficace
Les microbes de notre flore intestinale jouent un rôle crucial dans la formation et le fonctionnement de notre système immunitaire.
On sait depuis longtemps que les micro-organismes que nous hébergeons jouent un rôle dans nos défenses naturelles : en occupant le terrain, ils rendent difficile l’installation d’autres microbes. En outre, les études scientifiques menées depuis plusieurs années sur la flore intestinale révèlent que les bactéries font bien plus que cela : elles éduquent notre système immunitaire à distinguer les micro-organismes de notre microbiote d’éventuels intrus. Sans cette phase d’apprentissage, il nous serait impossible de tolérer ces milliards de bactéries intestinales tout en maintenant une forte et rapide réactivité contre d’autres micro-organismes étrangers potentiellement pathogènes. De plus en plus de travaux suggèrent d’ailleurs que certaines maladies inflammatoires (maladie de Crohn), auto-immunes (diabète de type 1, sclérose en plaques) ou allergiques pourraient provenir d’une mauvaise communication entre les bactéries intestinales et le système immunitaire. Mais les preuves les plus convaincantes du rôle du microbiote dans nos défenses naturelles proviennent des expériences sur les souris dites axéniques : des souris obtenues par césarienne et élevées dans des bulles stériles afin de maintenir une absence complète de micro-organismes dans leur intestin. Or ces souris ont un système immunitaire très immature. Leurs ganglions lymphatiques et leur rate, deux organes importants dans l’immunité, sont atrophiés et fonctionnent mal. Résultat : elles sont plus sensibles aux allergies et le moindre agent pathogène peut leur être fatal.
Un moyen de lutte contre l’obésité ?
C’est l’une des démonstrations pionnières du rôle du microbiote intestinal dans l’obésité : en 2006, des chercheurs américains ont transféré la flore de souris obèses à des souris dépourvues de microbiote intestinal. Résultat : elles prennent deux fois plus de poids que leurs congénères colonisées avec le microbiote de souris non obèses et soumises au même régime alimentaire. Chez l’Homme, des études ont confirmé que les personnes obèses ont en général une flore intestinale moins diversifiée, avec une plus grande proportion de certaines bactéries. Toutefois, aucune thérapeutique miracle n’a pour l’heure débouché de ces travaux…


Les Yanomami, champions de la flore
Les peuples de tribus isolées d’Afrique ou d’Amérique du Sud (ici, les Yanomami, à la frontière entre le Brésil et le Venezuela) ont une flore intestinale beaucoup plus riche en espèces bactériennes que celle des habitants des pays développés. À quoi est dû l’appauvrissement de notre flore intestinale ? À nos modes de vie : alimentation pauvre en fibres (moins de 10 % de la prise alimentaire dans le monde occidental), consommation massive d’antibiotiques, conditions d’hygiènes drastiques, notamment durant la période périnatale… Or, de plus en plus de chercheurs considèrent que cette perte de biodiversité pourrait favoriser l’apparition de certaines maladies, comme l’obésité ou le diabète.
L’architecte de nos humeurs ?
Communiquant sans cesse avec le cerveau, le microbiote intestinal a un impact sur notre mémoire, notre sommeil… et nos états d’âme !
Les résultats de multiples études, notamment d’expériences chez les rongeurs, sont formels : notre ventre agit bel et bien sur notre cerveau ! La composition de notre microbiote intestinal aurait ainsi une influence sur notre mémoire, notre stress, notre anxiété, notre personnalité ou encore notre joie de vivre. Comment ? En dialoguant sans cesse avec le cerveau. Car notre ventre contient lui aussi des millions de cellules nerveuses (neurones) qui peuvent communiquer, grâce à des messagers chimiques, avec celles du cerveau. Les bactéries intestinales jouent un rôle important dans cette communication. Elles produisent un grand nombre de molécules (dont des neurotransmetteurs) capables d’agir sur le cerveau en passant par le nerf vague ou la circulation sanguine. Ainsi, 95 % de la sérotonine, appelée « l’hormone du bonheur », est fabriquée dans notre intestin. Les souris dépourvues de bactéries intestinales ont d’ailleurs des comportements plus anxieux et dépressifs que les autres. Des expériences de transfert de microbiote entre deux lignées de souris montrent aussi que l’on peut modifier certains traits de caractère comme la témérité ou à l’inverse la prudence. Chez l’Homme, les études révèlent que le microbiote de patients souffrant d’anxiété, de dépression ou de troubles du spectre autistique diffère de celui des personnes en bonne santé. La prise de probiotiques (micro-organismes vivants naturellement présents dans les intestins) ou de prébiotiques (fibres alimentaires visant à nourrir les bactéries intestinales) pourraient, dans certains cas, diminuer ces symptômes. Des résultats qui restent à confirmer sur de larges populations.
Probiotiques : quelle efficacité ?
Selon l’OMS, les probiotiques sont « des micro-organismes vivants qui, lorsqu’ils sont ingérés en quantité suffisante, exercent des effets positifs sur la santé ». Toutefois, devant la déferlante d’« alicaments » aux promesses alléchantes, l’Agence de santé européenne a réévalué en 2012 toutes les allégations santé des probiotiques et… n’en a revalidé aucune, faute de preuves suffisantes. Des études ont néanmoins démontré des effets bénéfiques en cas de gastroentérite, d’intolérance au lactose, ou de recours répété aux antibiotiques. L’ingestion de certaines souches bactériennes pourrait même diminuer le risque d’infections hivernales chez les enfants et adultes sains. Mais cela reste à confirmer.