Sommes-nous tous des chimères ?
Nos cellules ne contiennent pas toutes le même génome : certaines proviennent d’autres individus. Baptisé microchimérisme, ce phénomène remet en cause notre vision de l’immunité et de l’identité biologique humaine : nous sommes tous des (micro)chimères !
Une enquête de Lise Barnéoud - Publié le
Une nouvelle discipline en biologie
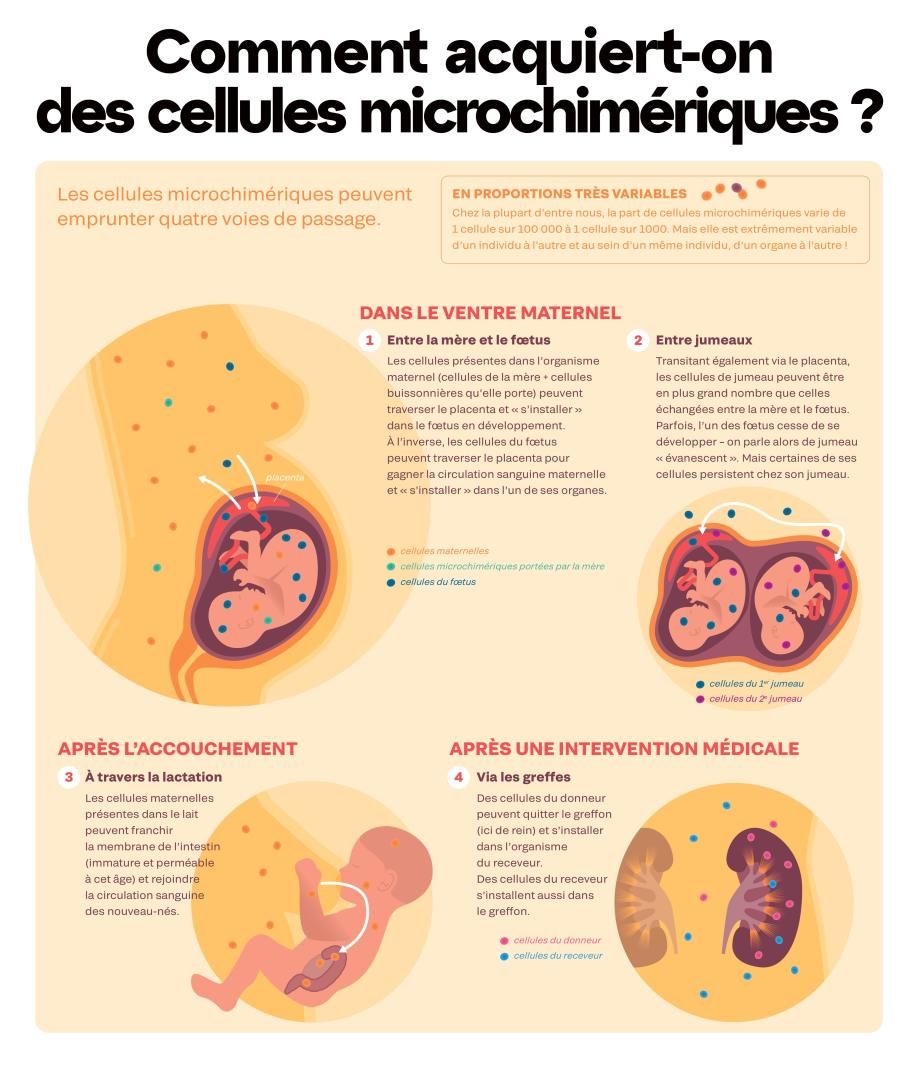
C’est une science en train d’émerger, un nouveau champ de recherche qui remet en cause bon nombre de nos connaissances. Nous nous pensions constitués de cellules au génome identique, toutes issues de notre première cellule-œuf, fusion de l’ovule et du spermatozoïde. En réalité, nous hébergeons toutes et tous des cellules en provenance d’autres individus. Un phénomène baptisé microchimérisme par les scientifiques, en référence au monstre de la mythologie grecque composé de plusieurs espèces. Mais ici, ce terme désigne les organismes constitués de cellules d’origines génétiques différentes. Ainsi, contrairement à l’équation courante « un individu = un génome », plusieurs génomes humains cohabitent en nous.
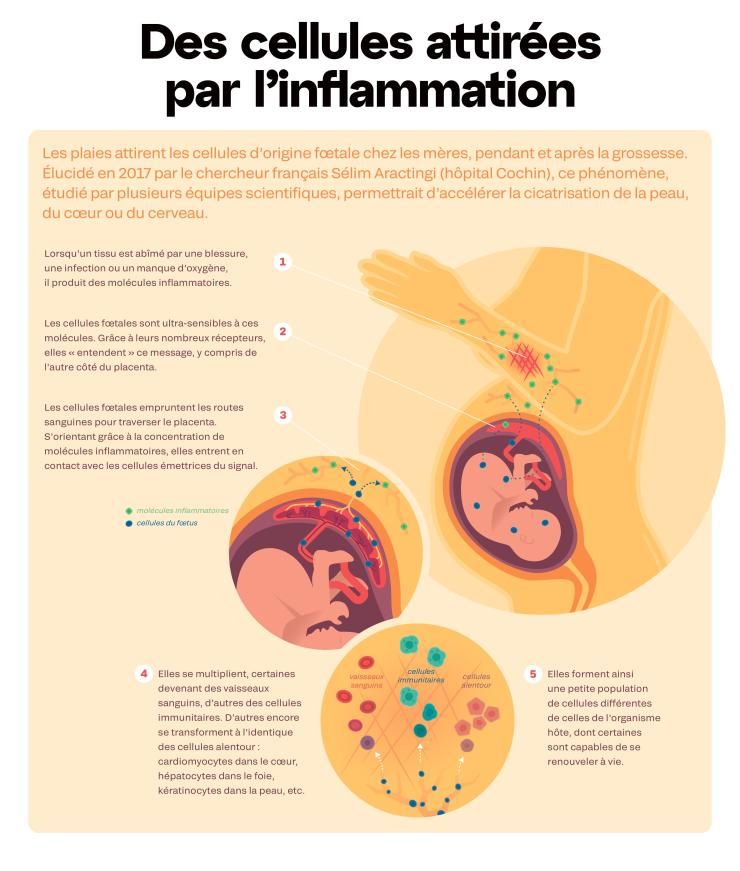
Depuis un siècle déjà, les chercheurs soupçonnent nos cellules de voyager de part et d’autre du placenta. Dès 1893, un chercheur allemand repère, dans les poumons de femmes décédées durant la grossesse ou l’accouchement, des cellules en provenance de leur fœtus. En 1953, on découvre que les jumeaux échangent des cellules in utero. Et dans les années 1960, des publications font état de cellules d’origine maternelle chez les nouveau-nés. À l’époque, on imagine que le système immunitaire va rejeter ces cellules « étrangères », faute de quoi un processus pathologique s’enclenchera. Trente ans plus tard, les biologistes démontrent qu’il n’en est rien : ces cellules persistent et sont la plupart du temps très bien tolérées. Objet d’intérêt scientifique croissant, ces « cellules buissonnières », malgré leur faible nombre, influencent notre physiologie, notre immunité, notre développement neuronal. Ouvrant ainsi de nouvelles perspectives en médecine.
Le ventre maternel, épicentre des échanges
Fin 2023, des chercheurs sont parvenus à visualiser le passage de cellules d’origine maternelle à travers les différentes membranes du placenta, jusqu’à la circulation sanguine du fœtus. Par ce même mécanisme, les jumeaux peuvent également s’échanger des cellules. On parle alors de « chimérisme gémellaire ». Ces cellules en provenance d’un jumeau se retrouvent parfois en quantité si importante qu’elles constituent des organes entiers ! Dans de rares cas, on les trouve à l’intérieur des organes reproducteurs, ce qui peut ainsi brouiller la filiation génétique.

La somme de ce que nous sommes
En 2021, une étude française fait l’effet d’une petite bombe : des cellules en provenance de grand-mères maternelles sont retrouvées dans le sang de 18 % de nouveau-nés testés (5 nourrissons sur 28). Ainsi, les femmes enceintes peuvent transférer non seulement leurs propres cellules à leur fœtus, mais aussi d’autres cellules comme celles provenant de leur propre mère.
Mais pas seulement ! Puisque ces voyages cellulaires se font dans les deux sens, les femmes accumulent durant leur vie reproductive des cellules en provenance de tous les embryons qu’elles ont portés : même en cas de fausse-couche ou d’avortement, des cellules s’immiscent dans l’organisme maternel.
Or ces cellules peuvent retraverser le placenta et s’immiscer dans un nouveau fœtus en développement. De cette manière, nous pouvons également hériter des cellules de celles et ceux qui nous ont précédés dans le ventre maternel.
Autre source de microchimérisme possible (non encore démontrée) : les frères ou sœurs aînés de la mère, ou son jumeau, vivant ou évanescent (fœtus d’un jumeau qui ne s’est pas développé). Ces cellules pourraient, des années plus tard, retraverser le placenta à l’occasion d’une grossesse. « Il existe probablement d’autres sources de microchimérisme qu’on ne connaît pas encore », indique Lee Nelson, qui a consacré sa carrière à étudier le phénomène à l’Institut Fred Hutchinson, à Seattle. La preuve : en 2005, une étude révèle que plus de 60 % des fœtus féminins mort-nés et 80 % des petites filles de moins de 2 ans possèdent des cellules microchimériques masculines dans leur foie. La plupart sans aucun jumeau ni aîné-garçon rapporté…

Nos enfants et nos mères dans nos cerveaux !
En 2022, une étude menée chez la souris montre que les cellules d’origine maternelle peuvent franchir la barrière hémato-encéphalique et influencer le développement neuronal du fœtus. En 2012, une précédente recherche, portant sur 54 femmes décédées, révélait que 63 % des femmes possèdent des cellules mâles dans leur cerveau ! L’étude ne permettait pas de savoir d’où proviennent ces cellules, ni s’il s’agit de neurones ou d’autres types cellulaires peuplant notre cerveau. Depuis, des études chez l’animal suggèrent que dans les semaines qui suivent la mise-bas, les cellules d’origine fœtale peuvent bel et bien se transformer en neurones dans le cerveau maternel.
Les multiples avantages du microchimérisme
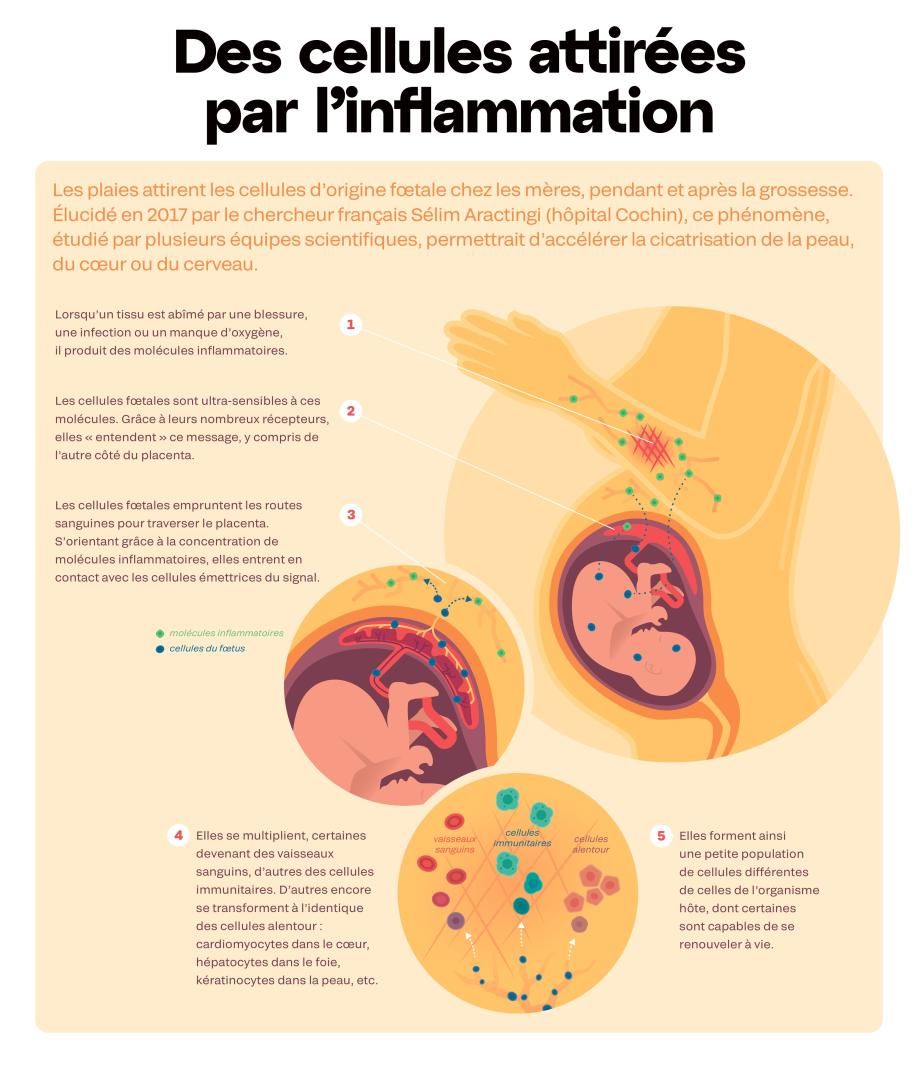
Jusqu’aux années 2000, les recherches visent avant tout à dénicher les rares cellules microchimériques. Aujourd’hui, l’objectif est de comprendre leur rôle. Loin d’être de passives voyageuses, elles prennent part en effet aux activités physiologiques des tissus. Comme les cellules souches présentes en chacun de nous, elles sont indifférenciées et capables de générer tous types cellulaires du corps humain. Si elles s’intègrent dans un cœur, elles deviennent des cardiomyocytes capables de battre aux côtés des autres cellules. Dans la peau, elles deviennent des cellules cutanées, etc. Elles sont donc susceptibles de réparer des tissus en remplaçant des cellules endommagées. D’où des perspectives prometteuses en médecine régénérative.
Elles auraient d'ailleurs - pour les cellules d’origine maternelle transmises aux fœtus - deux types d’effets bénéfiques sur les futurs bébés. Elles favorisent leur immunité et « façonnent les conditions optimales pour un fonctionnement cérébral sain plus tard dans la vie », affirme Petra Arck, professeure de médecine fœto-maternelle à Hambourg.
Le microchimérisme pourrait aussi constituer un avantage pour la reproduction. « Ces cellules semblent agir comme des négociatrices pour faciliter l’installation de ce corps semi-étranger qu’est le bébé à naître dans le corps de la mère », avance la biologiste américaine Amy Boddy. En outre, en s’installant dans les vaisseaux sanguins maternels qui irriguent le placenta, ces cellules élargissent leur diamètre et augmentent le flux de nutriments et d’oxygène vers le fœtus. Enfin, elles favoriseraient la lactation et inhiberaient l’ovulation de leur mère : un bon moyen de conserver l’exclusivité maternelle le plus longtemps possible, en repoussant l’arrivée d’un cadet !
Des cellules maternelles à la rescousse
Dans le pancréas d’un jeune garçon décédé de diabète, des chercheurs ont découvert plusieurs dizaines de cellules porteuses des deux chromosomes sexuels X (points rouges). Il s’agit donc de cellules féminines. L’analyse de marqueurs génétiques a montré que ces cellules provenaient de la mère du garçon. Et ce n’est pas tout : les chercheurs ont découvert que ces cellules étaient capables de produire de l’insuline. Ainsi, elles fournissaient cette hormone essentielle à l’enfant, alors même que son propre pancréas était devenu incapable d’en produire lui-même. Pas assez, toutefois, pour le maintenir en vie.

Le côté obscur du microchimérisme
« Ces cellules ne sont ni intrinsèquement bonnes ni intrinsèquement mauvaises », affirme Lee Nelson, spécialiste américaine du microchimérisme. Pour la plupart d’entre nous, la coexistence de cellules d’origines génétiques différentes, en effet, se passe bien.
Mais il arrive que les choses tournent mal. « En fonction de la quantité de cellules qui s’installent, de leurs caractéristiques génétiques, l’équilibre peut être rompu », envisage Nathalie Lambert, biologiste à l’Inserm et spécialiste du microchimérisme. Ainsi, le sang des personnes souffrant de maladies auto-immunes contient plus fréquemment, et en plus grande quantité, des cellules microchimériques. En outre, les femmes sont plus touchées en général par les maladies auto-immunes et les symptômes se déclarent le plus souvent après les grossesses, après « le plein » de cellules d’origine fœtale. D’où l’hypothèse d’un lien de causalité, non encore démontré : les cellules microchimériques deviendraient la cible du système immunitaire de l’hôte qui les identifie comme étrangères. Dans ce cas, il ne s’agirait plus à proprement parler de maladies « auto »-immunes, car notre système immunitaire ne s’attaquerait alors pas à ses propres cellules mais aux cellules “buissonnières” étrangères.
Ces cellules microchimériques pourraient aussi s’installer à l’intérieur d’une tumeur et prendre part à la fabrication de nouveaux vaisseaux sanguins qui contribuent à la propagation cancéreuse. Cela expliquerait pourquoi le pronostic de certains cancers (peau, sein) est moins bon s’ils se déclenchent durant la grossesse ou juste après l’accouchement, lorsque la concentration en cellules fœtales circulantes est la plus élevée.
Un microchimérisme aux macro-conséquences
En 2024, l’équipe de Nathalie Lambert, biologiste à l’Inserm, démontre que l’on peut hériter des prédispositions génétiques portées par nos cellules buissonnières. Lorsqu’une souris saine « récupère » des cellules microchimériques (quelle qu’en soit la provenance) porteuses d’un gène de prédisposition à la polyarthrite rhumatoïde, on identifie dans son sang des protéines spécifiques de la maladie, des anticorps impliqués dans la destruction de l’articulation. « Nous ne savons pas encore si les quantités mesurées peuvent déclencher la maladie, explique Nathalie Lambert. Mais c’est la preuve que même en faible quantité, ces cellules parviennent à produire des protéines détectables dans le sang. »
Un nouveau regard sur l’immunité
Au tournant du millénaire, nous découvrions la présence de milliards de cellules microbiennes en nous : notre microbiote. Nous possédons ainsi autant de cellules humaines que bactériennes ! Avec le microchimérisme, nous prenons désormais conscience que cette moitié d’humain que nous sommes n’est pas exclusivement constituée de nos propres cellules : certaines proviennent d’autres individus. « Être soi, c’est avant tout être fait par les autres, être fait des autres », résument l’immunologiste Edgardo Carosella et le philosophe Thomas Pradeu dans leur livre L’Identité, la part de l’autre. Ces découvertes bouleversent notre compréhension du corps et de l’identité humaine : « Nous ne sommes pas les produits d’un soi pur et homogène auto-construit », insiste Thomas Pradeu.
Le microchimérisme, comme le microbiote, remet aussi en cause notre vision classique de l’immunité comme d’un système intolérant, qui repère pour détruire le non-soi. L’omniprésence de cellules étrangères montre au contraire qu’il s’agit d’un système beaucoup plus tolérant, dans lequel « les différences deviennent précisément ce qui maintient le monde ensemble », propose le philosophe italien Roberto Esposito.
Dans le prolongement de ces réflexions, certains penseurs proposent d’adopter une perspective écologique sur l’individu : de le considérer dorénavant comme un assemblage hétérogène, un collectif de cellules. Les écologues l’ont démontré il y a longtemps : plus un écosystème est riche d’espèces, plus il saura surmonter les épreuves de la vie. Se pourrait-il que nous soyons nous aussi plus efficaces, plus résilients, parce que chimériques ?
Entrelacés, donc solidaires ?
En entrelaçant nos cellules, le microchimérisme renforcerait-il la coopération familiale ? C’est l’hypothèse formulée par des chercheurs spécialistes des ouistitis, chez qui toute la famille s’entraide pour élever les jeunes. Certains de ces petits singes possèdent des quantités très importantes de cellules buissonnières (en provenance notamment de leurs nombreux jumeaux), présentes dans les poils, la salive et la peau. Ce qui facilite la reconnaissance olfactive de la parenté. Résultat, constaté empiriquement par les chercheurs : les nouveau-nés qui possèdent des cellules chimériques dans ces tissus sont plus portés par leur père que ceux qui n’en possèdent pas.