Crispr-Cas9 : entre espoirs et vigilance
Dix ans après sa découverte, Crispr-Cas9 est utilisé quotidiennement dans les laboratoires. Applications médicales, adaptations végétales, « désextinction » d’espèces : cet outil de modification du génome offre des perspectives vertigineuses. Et en décembre 2023, l’Agence européenne du médicament a autorisé un traitement conçu grâce à Crispr-Cas9, contre deux maladies du sang. Une première !
Texte de Lise Barnéoud - Publié le , mis à jour le
Partout, la « folie Crispr » se poursuit
Des centaines de milliers de laboratoires l’utilisent partout sur la planète. Une cinquantaine d’essais cliniques sont en cours, grâce auxquels 200 personnes ont déjà été traitées. Des applications agricoles sont disponibles sur les marchés nord-américain ou japonais. Rarement une découverte en science fondamentale aura conduit en un délai si court à des transformations si radicales. Il y a quinze ans, ce qu’on nommait Crispr (pour Clustered Regularly Interspaced Short Palindromic Repeats) était une simple curiosité scientifique : un mode de défense des bactéries pour repérer et couper l’ADN des virus qui les infectent. Mais en 2012, la microbiologiste et généticienne française Emmanuelle Charpentier montre, avec l’Américaine Jennifer Doudna, qu’il est possible de programmer ce mécanisme pour cibler n’importe quelle section d’ADN et la couper. Résultat : un outil révolutionnaire de ciblage génétique et d’édition du génome, décrit dans leur article de référence, paru dans la revue Science en juin. Dès 2013, la même revue évoque la « folie Crispr » : des dizaines de laboratoires utilisent l’outil pour supprimer, ajouter, activer des gènes dans les cellules de bactéries, de souris, de rats, de poissons, de plantes ou… d’êtres humains. Dix ans plus tard, la palette d’usages de Crispr-Cas9 s’est élargie : édition fine du génome, mais aussi des ARN issus de la transcription du génome, et de l’épigénome – ces marqueurs qui influencent la lecture de nos gènes. Crispr et ses dérivés sont devenus indispensables à la recherche. Destinée à la prise en charge de la drépanocytose et de la bêta-thalassémie, la première « thérapie Crispr » a été autorisée par l’Agence européenne du médicament en décembre 2023, juste après les autorisations accordées par les agences britannique et américaine. Bref, ça va très vite. Trop vite, peut-être. Car au-delà des incertitudes sur ses risques, se posent des questions éthiques et sociétales.
Le premier visage humain de Crispr-Cas9
Victoria Gray est l’une des premières patientes traitées grâce à Crispr, en 2019. Quatre ans plus tard, en 2023, lorsqu’elle raconte son histoire à l’occasion du troisième Sommet international de l’édition du génome, l’émotion est palpable. Ici, l’outil a permis de couper un gène défaillant responsable de la maladie génétique la plus commune : la drépanocytose. Et ce n’est pas tout. Les données de suivi des 83 personnes incluses dans cet essai clinique s’avèrent très encourageantes. À la fin de l’année 2023, cet essai avait conduit à la première autorisation réglementaire d’une thérapie Crispr au Royaume-Uni, aux États-Unis et en Europe. Mais son coût, supérieur au million d’euros, en limitera drastiquement l’accès.

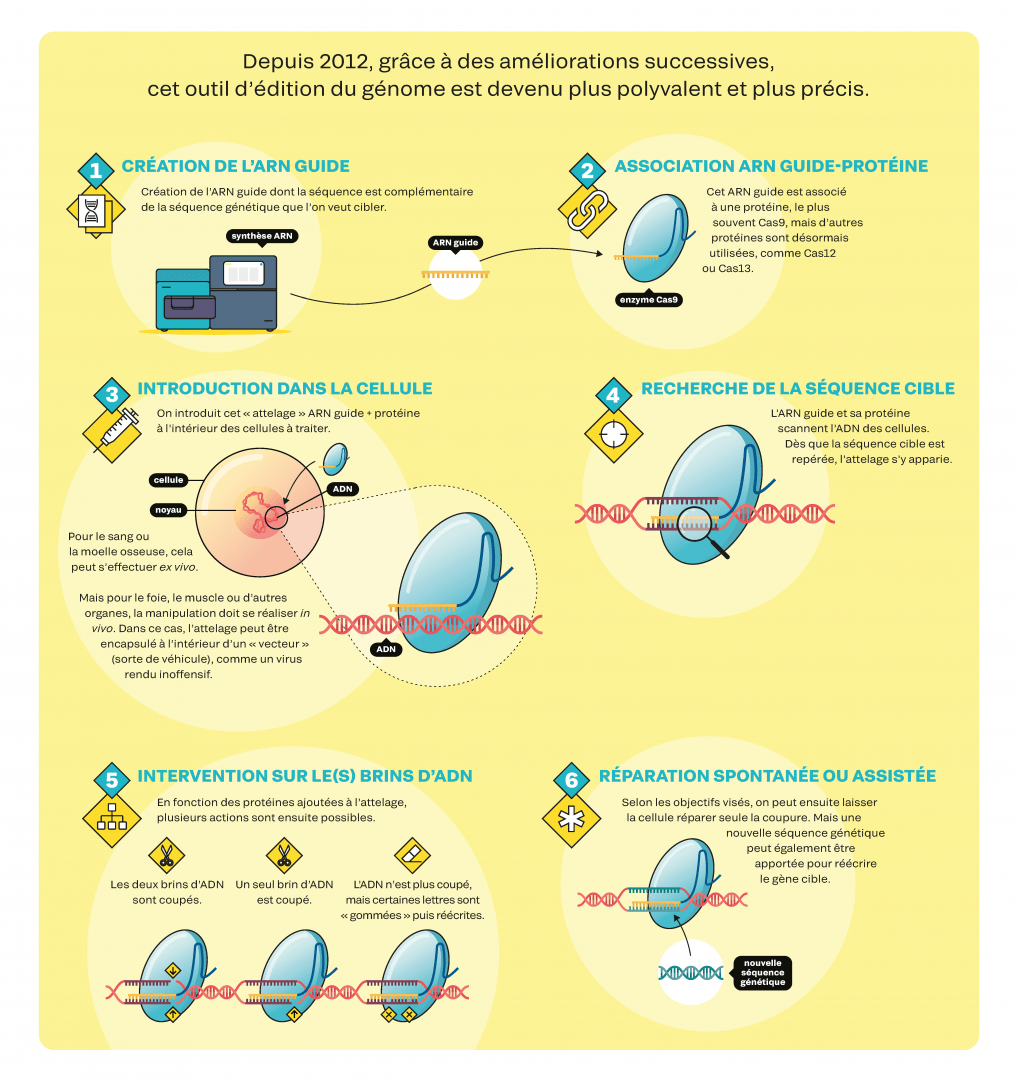
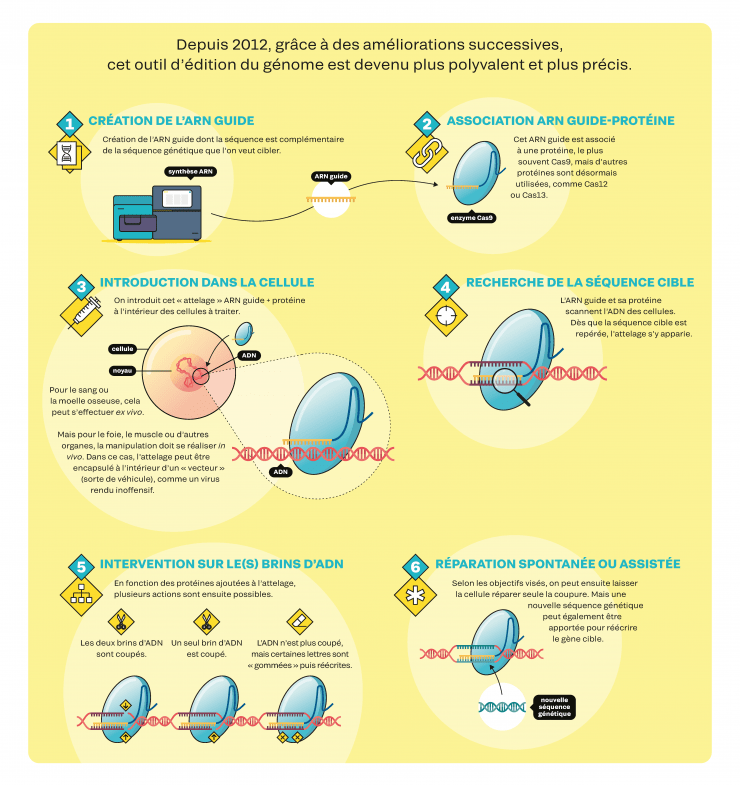
CRISPR-Cas9, mode d’emploi
Une révolution dans les labos
En biologie, il y a clairement un « avant » et un « après Crispr ». L’utilisation de cette boîte à outils est en effet simple et rapide. En outre, aucun brevet ne limite son utilisation dans la recherche fondamentale : il suffit de connaître la séquence génétique visée pour retrouver, dans les vastes bibliothèques en ligne, les constructions déjà mises au point par d’autres équipes et les commander, pour moins de 100 euros. Voilà pourquoi la plupart des laboratoires de biologie manient désormais quotidiennement Crispr-Cas9 et ses dérivés. Nombreux sont ceux qui l’utilisent pour étudier le rôle des gènes et de leurs mutations : grâce à Crispr, on peut aisément observer les conséquences de l’inactivation d’un gène. D’autres s’en servent pour modifier des lignées cellulaires humaines in vitro, afin de mieux comprendre le développement d’une maladie ou tester des molécules à vocation thérapeutique. D’autres encore modifient les cellules embryonnaires d’animaux de laboratoire afin qu’une fois adultes, toutes leurs cellules contiennent sur leur ADN la modification apportée. Cela permet de générer, par exemple, de nouveaux modèles de maladies génétiques humaines. « Il s’agit d’une disruption technologique. Des recherches qui prenaient auparavant plus d’un an peuvent s’effectuer en quelques semaines, à un coût dix fois moindre », souligne le biochimiste Rodolphe Barrangou, directeur du CRISPR Lab à l’université d’État de Caroline du Nord, aux États-Unis. À noter : si la communauté scientifique bénéficie d’un accès gratuit à la technique, une utilisation commerciale oblige en revanche à payer des redevances aux détenteurs de brevets. Il en existe plus de 11 000 liés à Crispr, selon les protéines utilisées, leurs finalités, etc.
Crispr déjà présent dans certaines assiettes
En mai 2023, les États-Unis ont autorisé, à titre expérimental, la consommation de porc génétiquement modifié via Crispr. Destiné à améliorer la qualité de la viande et la résistance du bétail au changement climatique, ce projet de recherche consiste à rendre des porcs stériles, puis à transplanter dans leurs testicules des cellules souches d’animaux donneurs, capables de produire des spermatozoïdes. Aux États-Unis, au Canada ou au Japon, des aliments « crisperisés » sont en vente depuis 2014 : un colza résistant à des herbicides, des poissons qui grossissent plus vite, un champignon qui ne s’oxyde pas… En France, aucun aliment crisperisé n’a encore obtenu d’autorisation de culture ni de mise sur le marché.
Être ou ne pas être un « nouvel OGM »
Faut-il considérer les plantes dont le génome a été édité par ces nouvelles techniques génomiques comme des OGM ? Oui, répond la Cour de justice de l’Union européenne en 2018 : l’ADN a bien été modifié directement par la main de l’Homme. Mais pour les industriels, dès lors qu’il n’y a pas d’ajout de gènes nouveaux, « on ne fait qu’accélérer des modifications qui pourraient se produire dans la nature ou par croisements sélectifs ». C’est évacuer un peu rapidement la question de la traçabilité : les techniques actuelles ne permettent pas toujours d’identifier ces modifications volontaires d’ADN. En juillet 2023, la Commission européenne avance une nouvelle proposition de loi. Si le Parlement l’approuve, sans doute pas avant les élections européennes de 2024, les plantes dont les modifications d’ADN pourraient être produites par sélection naturelle ne seront plus considérées comme des OGM. Elles pourront être cultivées et commercialisées sans label particulier (sauf en agriculture biologique où elles restent interdites). Dans une simple notification, les semenciers devront prouver que les modifications génétiques induites peuvent être obtenues naturellement. En revanche, si la modification ne peut intervenir spontanément, ou si elle vise à rendre la plante résistante aux produits phytosanitaires, elle devra toujours faire l’objet d’une autorisation et devra être labélisée « NGT » (New Genomic Techniques). Ce changement d’approche aurait pour vertu la mise au point de cultures plus productives et plus résistantes aux conditions climatiques. Mais il pourrait aggraver la dépendance des agriculteurs à une poignée d’industriels, qui ont commencé à breveter massivement ces semences.
Un outil capable de tout dépister ?
Détecter grâce à Crispr des segments génétiques de virus (Zika, Covid, dengue, grippe…), de bactéries (tuberculose, staphylocoque, listeria…) et de tumeurs (microARN spécifiques) améliorerait le dépistage considérablement. Comme aucun équipement particulier n’est nécessaire, ces nouveaux outils diagnostiques pourraient être utilisés directement sur le terrain : un atout de taille en cas d’épidémie. En 2020, un premier autotest Covid basé sur cette technologie a été autorisé aux États-Unis. La plupart de ces tests utilisent d’autres protéines que la célèbre Cas9 : lorsqu’elles détectent le segment génétique cible, un signal fluorescent est produit, qui sert d’indicateur visuel.

Des applications potentielles en médecine
En corrigeant une mutation ou en substituant un gène sain à un gène muté, Crispr représente un immense espoir pour guérir les maladies génétiques, en particulier les 7 000 maladies « monogéniques », qui résultent d’une mutation dans un seul gène. Les essais cliniques les plus avancés concernent ainsi la drépanocytose et la bêta-thalassémie – aboutissant aux premières mises sur le marché d’un « médicament Crispr », le Casgevy, destiné à les prendre en charge fin 2023. S’agissant de maladies du sang, le traitement se fait ex vivo : les cellules sanguines sont prélevées, modifiées grâce à Crispr, multipliées puis réinjectées par transfusion. D’autres essais cliniques portent sur des maladies de l’œil, comme l’amaurose congénitale de Leber, car les cellules se trouvent à la surface du corps et sont donc faciles d’accès. D’autres, encore, sur des maladies du foie, à l’instar de l’amyloïdose héréditaire à transthyrétine : les scientifiques ont développé des vecteurs qui permettent d’acheminer le système Crispr jusque dans l’organe hépatique. Toutefois, c’est le domaine oncologique, en particulier les cancers du sang, qui compte le plus d’essais cliniques en cours. L’idée : modifier génétiquement les lymphocytes T, des cellules immunitaires, pour les rendre capables d’identifier et d’attaquer les cellules malades. Un à trois ans après avoir bénéficié d’un tel traitement, une vingtaine de patients atteints de lymphome sont désormais en rémission complète. Enfin, la lutte contre les infections pourrait bénéficier de cet outil, capable de cibler la séquence génétique d’une bactérie pathogène. Un essai clinique a également démarré aux États-Unis contre le sida. Objectif : générer une mutation empêchant le VIH de pénétrer les cellules immunitaires.

Le spectre repoussant des « bébés sur mesure »
Si Crispr permet de modifier des cellules adultes, il peut aussi être utilisé sur des cellules embryonnaires… éthique mise à part ! En 2018, le biologiste chinois He Jiankui annonce avoir modifié des embryons humains grâce à Crispr-Cas9 : trois enfants sont ainsi nés porteurs d’une mutation qui confère une résistance au sida. La communauté scientifique condamne vivement l’expérience, faute de garanties suffisantes sur son efficacité et sa sécurité, et alors même que les conditions du consentement éclairé des couples n’ont pas été réunies. Le chercheur, qui a passé trois années en prison pour « pratique médicale illégale », souhaite poursuivre ses recherches, mais dorénavant sur des cellules adultes.
Encore de nombreux doutes et défis
Corriger un gène déficient sur des cellules in vitro est une chose. Parvenir à le faire in vivo, au bon endroit et sans risque, en est une autre. Or l’une des principales difficultés du système Crispr réside dans son transport jusqu’à l’organe cible. La méthode la plus utilisée est celle du transport viral : des virus rendus inoffensifs acheminent Crispr et ses protéines associées jusqu’aux noyaux des cellules visées. En se multipliant, ce vecteur permet une production continue de Crispr, avec donc une efficacité importante. Mais des réactions immunitaires à ces vecteurs viraux ont entraîné des échecs et même un décès lors d’un essai clinique aux États-Unis. D’autres vecteurs sont à l’essai, notamment les nanoparticules lipidiques utilisées dans les vaccins contre le Covid-19. Quant à l’innocuité de l’outil même, plusieurs risques ont été identifiés. Le système Crispr peut « couper » au mauvais endroit, sur une séquence génétique ressemblant à la séquence cible. Il peut faire des erreurs de correction dans la cible. Il peut déclencher des mécanismes de réparation cellulaire non souhaités, en particulier lorsque deux brins d’ADN sont coupés. Enfin, il peut générer des interférences inattendues sur d’autres gènes. « Lorsqu’on touche des millions de cellules comme c’est le cas dans les applications thérapeutiques, il faut vraiment s’assurer que ces effets non désirés ne se produisent pas dans les cellules traitées », prévient la biophysicienne Carine Giovannangeli (MNHN). Pour l’heure, cependant, les données disponibles, avec des suivis s’étalant jusqu’à quatre ans, s’avèrent rassurantes. Plusieurs autorisations de mise sur le marché pour des applications thérapeutiques sont attendues au cours des deux prochaines années.
Un outil capable d’éradiquer une espèce ?
Une équipe internationale de chercheurs a utilisé Crispr-Cas9 pour rendre stériles les moustiques femelles et leur descendance. Menée à bien en 2021 dans de grandes cages, en Italie, une expérience montre ainsi que l’on peut supprimer une population entière en l’espace d’un an. L’objectif ? Se débarrasser de ces vecteurs du paludisme. Des essais grandeur nature sont envisagés dans cinq à dix ans. Toutefois, cette technique dite de « forçage génétique » suscite des inquiétudes : outre le risque d’un échange de gènes et donc d’un possible transfert du système Crispr à d’autres espèces proches, la disparition d’une espèce peut entraîner des impacts difficilement prévisibles sur le reste de l’écosystème.


Un outil capable de ressusciter une espèce ?
En comparant le génome d’un dodo, prélevé sur un spécimen conservé dans un muséum, à celui du pigeon de Nicobar, son plus proche parent vivant, des chercheurs américains ont détecté les principales différences génétiques entre les deux animaux. Grâce à Crispr, ils envisagent de réécrire le génome du pigeon pour le rapprocher de celui du mythique oiseau disparu. Les cellules ainsi modifiées seraient ensuite insérées dans un œuf d’où pourrait éclore un nouveau premier dodo. D’autres projets dits de « désextinction » concernent le mammouth laineux ou le loup de Tasmanie. Des projets controversés, entre autres car il est peu probable que ces animaux survivent aujourd’hui à l’état sauvage.
Un outil capable de sauver les forêts ?
De nouvelles variétés d’eucalyptus ou de peupliers à la croissance plus rapide et à la résistance accrue aux fléaux naturels comme la sécheresse, le gel ou les maladies : c’est ce que cherchent à créer des chercheurs de l’université d’État de Caroline du Nord grâce à Crispr. Alors qu’il fallait auparavant quinze ans au moins pour sélectionner et produire des variétés améliorées, quelques mois suffisent désormais pour modifier plusieurs gènes d’intérêt, tester leurs impacts et produire, par clonage, les meilleurs spécimens.