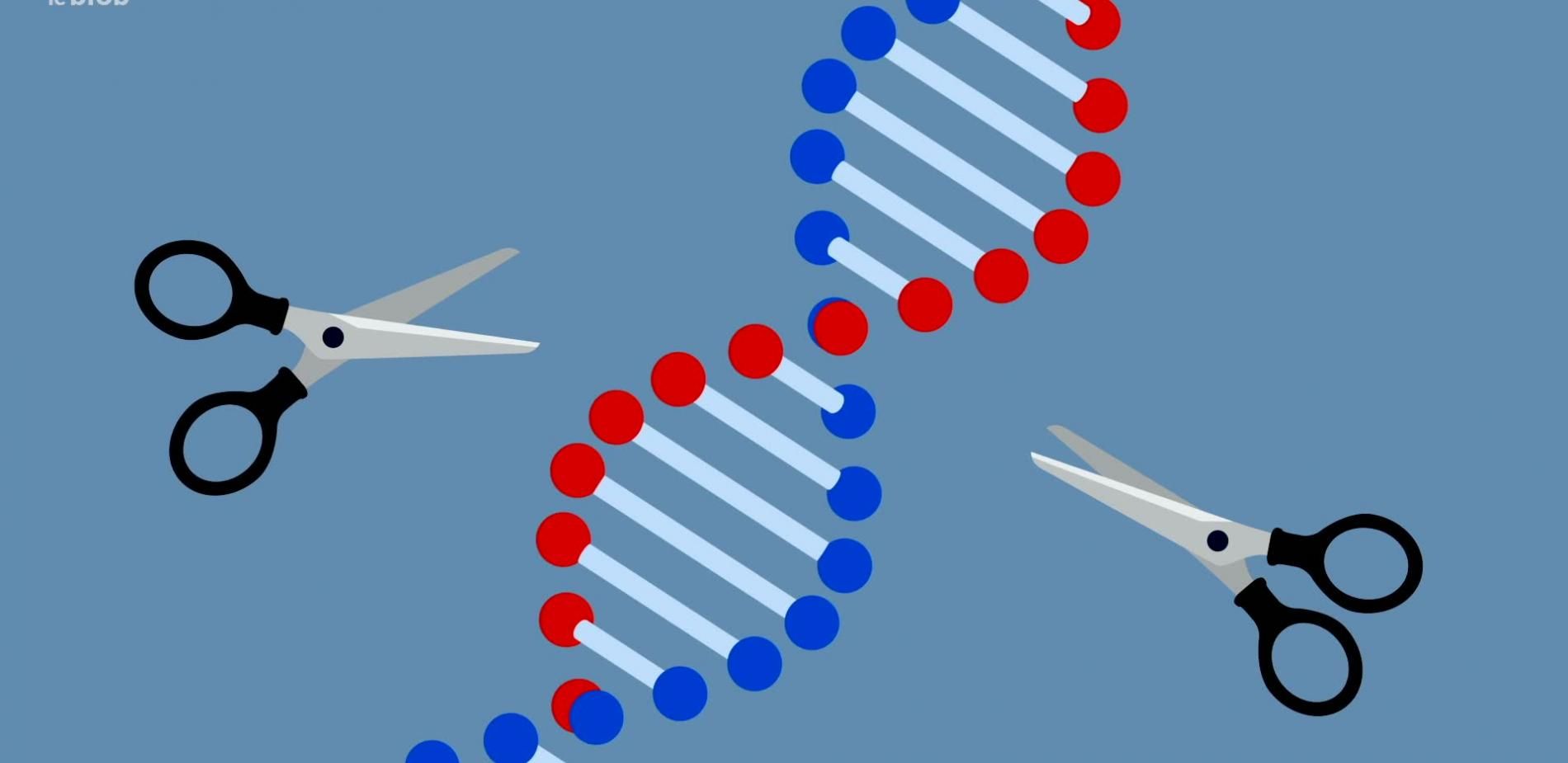
25 millions. C'est le nombre d'Européens atteints de l'une des 7000 maladies rares. Trouver le remède miracle pour chacune : le rêve de scientifiques du monde entier. Et si Crispr-Cas9 était la clé de ce défi hors norme ? Au Sud de Paris, le Généthon, laboratoire spécialiste des maladies rares. Derrière ces murs, plus de 200 chercheurs dont Mario Amendola. Il dirige l'équipe d'édition du génome. Ses recherches ont été bouleversées par la découverte de Crispr-Cas9. C'était en 2012. - J'ai toujours travaillé avec la modification de l'ADN. Et on ne pouvait pas faire grand-chose jusqu'à l'arrivée de Crispr et de tous les outils similaires. Maintenant, on peut faire des choses qu'on n'avait jamais entendues ou imaginées. Crispr-Cas9 : on le compare souvent à des ciseaux. Leur particularité ? Couper l'ADN à un endroit précis du génome dans n'importe quelle cellule. - Ça veut dire pouvoir modifier de manière spécifique un nucléotide, dans les billions de nucléotides qu'on a dans le génome. À l'étage du dessous, c'est sous ces hottes que les cellules sont modifiées. Ces scientifiques travaillent sur la myopathie de Duchenne. Une maladie qui touche 150 à 200 garçons nouveau-nés par an. - Le problème de cette maladie est qu'il manque une protéine spécifique dans le muscle du patient. Cela peut poser des problèmes au niveau des muscles. Il ne s'agit pas seulement des muscles qui nous permettent de bouger, mais aussi du cœur ou du diaphragme. Donc tout ce dont on a besoin pour vivre. Après quelques années, Crispr a livré un premier espoir. Une étude du laboratoire, encore non publiée, démontre un effet bénéfique, du moins sur l'animal. Avant et après modification, les cellules sont ici observées, colorées sur ordinateur. - Ici, on voit un muscle de souris malade, qui a la maladie de Duchenne. Elle a des caractéristiques typiques de souris malade. Par exemple, les noyaux qui sont en bleu, sont au milieu de la cellule, au lieu d'être sur le pourtour. Mais aussi, l'un des partenaires de notre protéine d'intérêt est très peu présent sur l'extérieur des fibres. Cette protéine manquante, c'est la dystrophine. Pour leur thérapie génique, les chercheurs ne l'ont pas réparée. Ils ont plutôt misé sur l'augmentation d'une protéine similaire : l'utrophine. - Voilà l'objectif qu'on veut atteindre : à savoir une souris saine, un muscle normal, avec les noyaux autour des fibres, sur l'extérieur, et un partenaire protéique beaucoup plus présent, indiquant un muscle plus fonctionnel. Une preuve de concept expérimentée uniquement sur 3 souris. Les recherches continuent avec un échantillon plus large. - Il faut beaucoup de preuves de sécurité, démontrant que la thérapie ne risque pas de provoquer des effets secondaires graves. Et cela prend des dizaines d'années, avant de passer à un essai clinique sur l'humain. L'humain sera-t-il un jour soigné grâce à Crispr ? C’est prometteur pour une autre maladie : la drépanocytose. Londres, il y a quelques mois, lors d'un colloque. Une patiente américaine de 47 ans incarne une prouesse technologique. Les cellules de Victoria Gray ont été modifiées grâce à Crispr. Elle est désormais guérie. Le médecin s'est assis à mon chevet et m'a présenté l'option de la thérapie génique Crispr. Il m'a expliqué comment ça se déroulerait et que si j'acceptais, je serais dans le 1er cercle des patients à participer à l'essai. La drépanocytose est la maladie monogénique la plus répandue dans le monde. Elle affecte les globules rouges, responsables du transport de l'oxygène dans le sang. À ce jour, plusieurs essais cliniques sont en cours. - Il y a quelques années, on ne pensait pas que ce serait possible de pouvoir injecter cela au patient et obtenir des résultats aussi positifs. On a sur certains patients environ 80% de restauration d'une hémoglobine normale. Les essais se poursuivent pour détecter des effets secondaires. D'ici 2024, les autorités sanitaires pourraient accorder une mise sur le marché. Ce serait une première avec Crispr. - À l'heure actuelle, les patients traités doivent revenir régulièrement à l'hôpital pour recevoir des transfusions de sang, de nouveaux traitements ou autres. L'avantage de Crispr, c'est un traitement un jour, et l'effet est pérenne sur de nombreuses années, voire pour toujours. Mais Crispr est loin d'être une paire de ciseau magique. Sur d'autres maladies, les erreurs constatées sont nombreuses. - Il y a plein d'erreurs possibles, comme la translocation de chromosome, une insertion à un autre endroit dans le génome. La liste n'est pas exhaustive, mais il peut y avoir de multiples erreurs. On veut donc en éviter le maximum. Maladies héréditaires, mais aussi cancers : à ce jour, plus de 70 essais cliniques Crispr-Cas9 sont en cours dans le monde.