Nouveaux regards sur l’endométriose
Longtemps méconnue, l’endométriose bénéficie enfin d’une forme de reconnaissance sociale et d’un nouvel essor de la recherche.
Enquête de Kassiopée Toscas - Publié le
Le constat est sévère : cette maladie gynécologique inflammatoire chronique affecte près d’une femme sur dix en âge de procréer, induit douleurs chroniques et parfois infertilité, mais est encore diagnostiquée avec sept à dix ans de retard. Jusque-là passée sous silence, l’endométriose occupe enfin le devant de la scène, politique et scientifique. La France a ainsi lancé une stratégie nationale en janvier dernier, devenant l’un des premiers pays au monde à en faire un véritable enjeu de santé publique. De leur côté, gynécologues, médecins de la reproduction, généticiens et épidémiologistes tentent de mieux comprendre sa distribution, ses causes et ses mécanismes physiologiques, tout en améliorant son diagnostic et sa prise en charge. La recherche n’en est qu’à ses débuts.
De nombreuses zones d’ombre
Entre méconnaissance historique et complexité biologique, l’endométriose et ses mécanismes sont, encore aujourd’hui, mal compris.
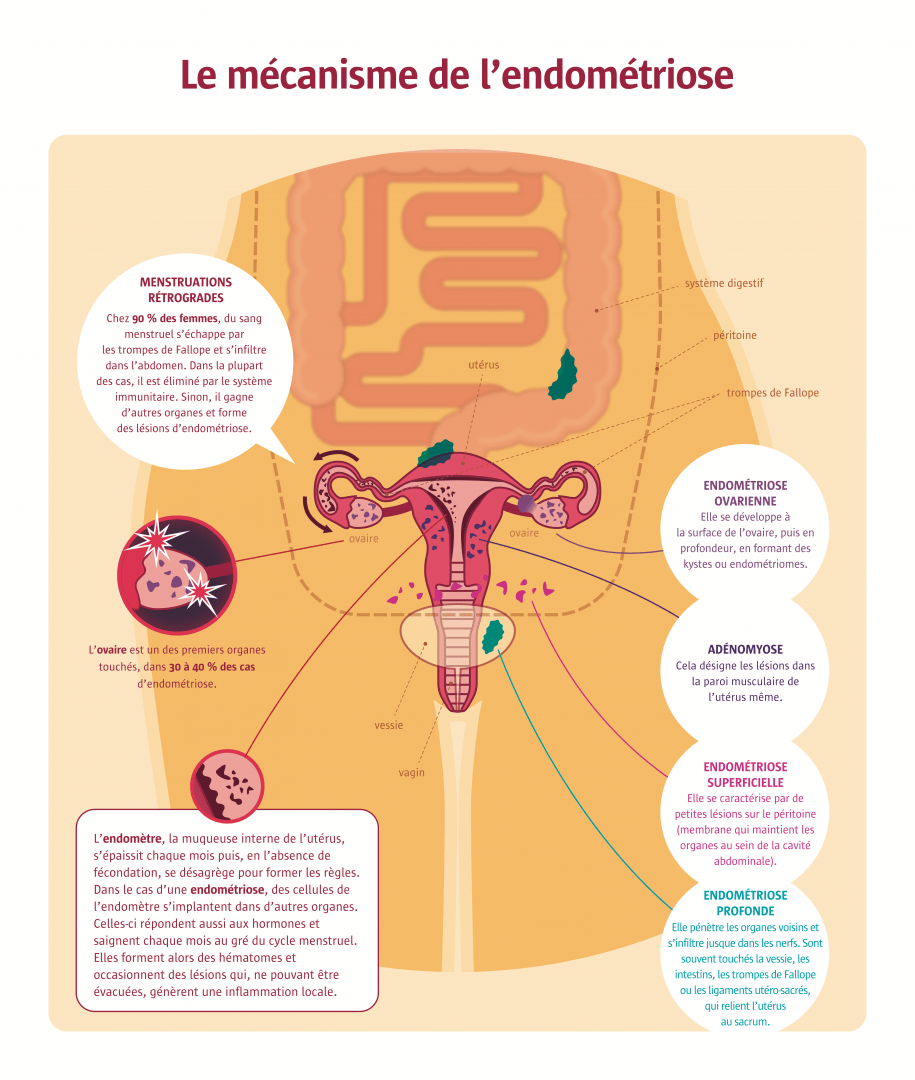
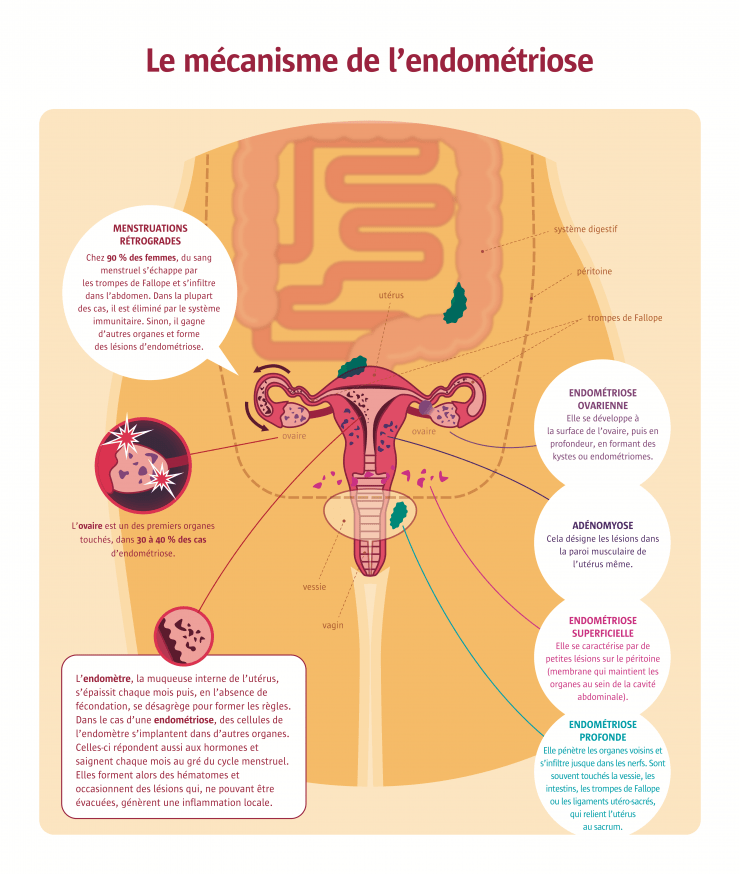
Sans doute apparue avec les premiers Homo sapiens, l’endométriose a été cliniquement décrite en 1860 par le médecin autrichien Carl von Rokitansky. Il s’agit de la présence d’endomètre — la muqueuse interne de l’utérus — en dehors de la cavité utérine. Il a pourtant fallu attendre le 21e siècle pour que l’on saisisse l’ampleur de ses impacts sur la santé des femmes, septembre 2020 pour que son enseignement soit inscrit dans les cours de second cycle d’études médicales et janvier 2022 pour qu’un plan national soit lancé. Pourquoi une reconnaissance si tardive ? Les douleurs menstruelles, le principal symptôme de l’endométriose, ont longtemps été considérées comme un mal inhérent au corps de la femme, une douleur humaine dépourvue de cause pathologique. Les préjugés sociaux sur les douleurs féminines étant peu à peu levés et la connaissance progressant, les chercheurs savent aujourd’hui que l’endométriose est une véritable maladie aux mécanismes physiologiques complexes. Comment de l’endomètre peut-il se retrouver hors de l’utérus ? Pourquoi n’a-t-il pas été éliminé par le système immunitaire ? Aucune théorie ne parvient à expliquer l’ensemble des cas observés, très divers. La théorie dite du « reflux de sang menstruel », qui s’échappe par les trompes de Fallope et s’infiltre dans l’abdomen, rend toutefois compte de la plupart des cas d’endométriose. Mais ce phénomène de reflux se produit chez 90 % des femmes, quand seules 10 % d’entre elles sont atteintes d’endométriose : d’autres causes doivent donc entrer en jeu. Les études se multiplient pour démêler l’enchevêtrement de facteurs à l’œuvre.

Une maladie connue dès l’Antiquité
Une maladie connue dès l’Antiquité Dès le 5e siècle avant notre ère, les Grecs recensaient des symptômes de maladies gynécologiques étrangement similaires à ceux de l’endométriose : un dysfonctionnement menstruel entraînant des douleurs utérines, voire une infertilité, et la grossesse comme remède. Leur toute première mention remonterait même aux anciens Égyptiens, en 1855 av. J-C. Et tout au long de l’histoire, des maladies analogues ont été identifiées par les savants, signes d’un utérus « vagabond » privé de sa fonction reproductive à l’Antiquité, ou de péchés et possession démoniaque au Moyen Âge. Avec une constante : les douleurs utérines trahissaient un comportement déviant, et non une réelle pathologie.
Des cas extraordinaires
Dans de rares cas, des lésions d’endométriose se retrouvent sur des organes, voire chez des patients, complètement inattendus.
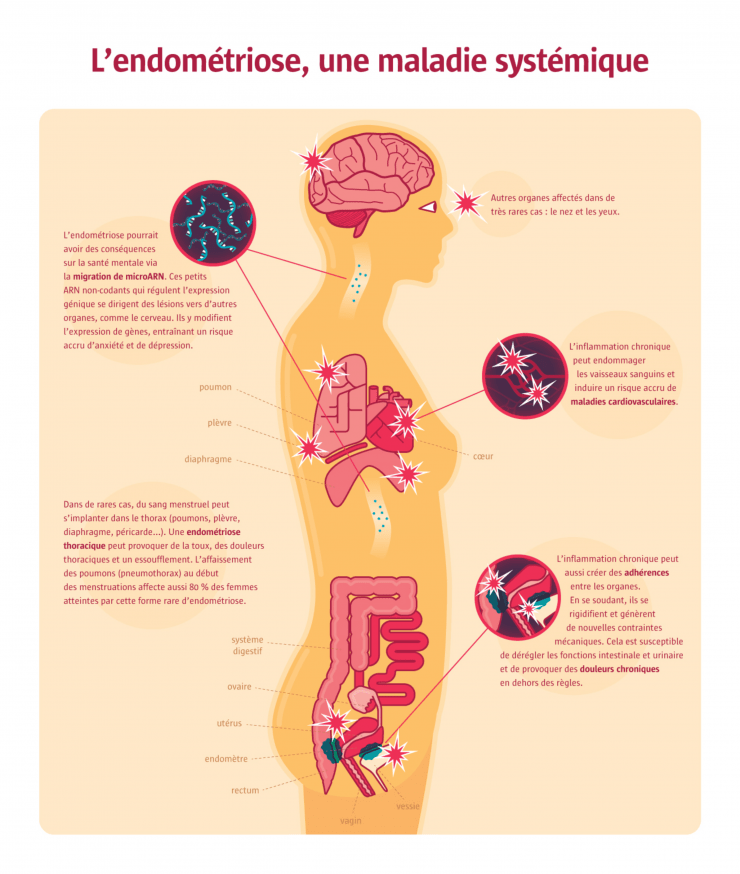
Des cas d’endométriose hors du commun ont suscité de nouvelles hypothèses, parfois controversées. Des organes éloignés de l’utérus peuvent en effet présenter des lésions – poumons, plèvre, diaphragme, péricarde, cerveau, nez ou yeux – entraînant un chapelet de nouveaux symptômes. Cela pourrait s’expliquer par la migration des cellules de l’endomètre dans le système vasculaire ou lymphatique, à la manière des cellules tumorales. De très rares cas ont aussi été rapportés chez des fœtus féminins. La dislocation du tissu endométrial primitif en dehors de la cavité utérine lors de la formation des organes pourrait alors en être la cause. Enfin, il est arrivé que des jeunes filles non menstruées et des hommes développent une endométriose après un traitement œstrogénique à forte dose, pour traiter un cancer de la prostate ou suppléer une carence d’origine auto-immune ou virale, par exemple. Cela serait dû à la transformation, sous l’effet de la stimulation hormonale, de cellules déjà différenciées en cellules de l’endomètre. Les cellules concernées peuvent être des vestiges des canaux de Müller (l’organe embryonnaire qui fournit l’appareil génital féminin et s’atrophie chez les mâles) après une organogenèse défectueuse. Ou des cellules des cavités abritant les poumons, le cœur ou les viscères, car celles-ci sont toutes dérivées de la cavité générale de l’embryon, elle-même liée aux canaux de Müller ! Une autre théorie, plus récente, est celle de la reprogrammation de cellules souches extra-utérines. Une équipe de l’école de médecine de Yale a en effet montré que des cellules souches de la moelle osseuse pouvaient se transformer en cellules endométriales.
Une maladie plurielle
Les symptômes de l’endométriose sont extrêmement variés, et une meilleure typologie de la maladie s’impose.
Les chercheurs sont unanimes : il n’existe pas une, mais des endométrioses. Cependant, les différents profils identifiés – l’endométriose ovarienne, superficielle, profonde, et l’adénomyose – ne sont corrélés ni à l’agressivité de la maladie ni aux symptômes. L’infertilité n’affecte en effet que 30 à 40 % des femmes souffrant d’endométriose, que ce soit dû à l’inflammation chronique, qui pourrait diminuer les chances d’implantation, voire de fécondation, ou à la présence de kystes ovariens, qui impactent la réserve d’ovocytes. Un surrisque de 10 % de fausse couche précoce a aussi été mis en évidence par une étude française en 2016. Quant aux douleurs, toutes les femmes n’en ressentent pas. Et même chez celles qui souffrent, les symptômes varient énormément, allant de la dysménorrhée (douleur pendant les règles) à la dyspareunie (douleur pendant les rapports sexuels), en passant par les douleurs pelviennes non cycliques, les douleurs à la miction et à la défécation. Le prochain grand défi sera donc de caractériser les manifestations de la maladie, identifier des sous-groupes pour chacun de ces profils selon des paramètres restant à définir – peut-être des indices de prolifération des lésions ou des taux de récepteurs aux hormones – afin de prédire la progression de la maladie et d’adapter les traitements. Cette nouvelle classification pourrait aussi se baser sur les seuils de douleur à certains stimuli ou encore sur les microARN, au profil peut-être variable suivant le type d’endométriose. Toutes les options sont explorées.
Le système immunitaire en cause ?
Si près de la moitié des cas d’endométriose est liée à une transmission héréditaire, le reste est dû à une combinaison complexe de facteurs.
Il est difficile de définir avec certitude la cause de l’endométriose. Soit l’endomètre est pathologique et plus agressif, soit le système immunitaire est plus permissif et le laisse s’implanter n’importe où. Et ces hypothèses ne sont pas exclusives… En 2021, une équipe de l’Institut Cochin, à Paris, a conclu que 51 % des cas étaient d’origine génétique. Mais derrière cette « héritabilité », il y a une très grande quantité de gènes impliqués, dont les généticiens ont pu seulement identifier une petite partie. Le reste, c’est « l’héritabilité manquante », aussi appelée « matière noire génétique ». Et comme dans toutes les maladies polygéniques, c’est-à-dire impliquant plusieurs gènes, c’est certainement la synergie entre plusieurs variants génétiques qui induit la maladie à travers, par exemple, un dysfonctionnement du système immunitaire. Celui-ci joue en effet un rôle de premier plan dans l’endométriose, car il peut stimuler la croissance des lésions en se suractivant et en entraînant une inflammation chronique. En 2020, une autre équipe de l’Institut Cochin a d’ailleurs constaté que certaines cellules de l’immunité innée, les macrophages, jouaient un rôle clé dans la progression de l’endométriose. De plus, celle-ci est associée à toute une série de pathologies auto-immunes comme le lupus, la maladie de Crohn, la sclérodermie… Un dysfonctionnement immunitaire pourrait donc être le moteur premier de l’endométriose, mais cela reste à démontrer.

Des facteurs environnementaux
L’environnement pourrait jouer un rôle dans la progression de l’endométriose, en particulier l’alimentation, dont le rôle encore incertain est exploré par les chercheurs. Les dioxines présentes dans les graisses animales, à l’instar de certains pesticides organochlorés, sont des perturbateurs endocriniens (capables d’interférer avec notre système hormonal) associés à l’endométriose. L’exposition à des hormones de synthèse qui imitent les œstrogènes pourrait aussi prédisposer à la maladie, comme en a témoigné le scandale du Distilbène. Prescrit aux femmes enceintes jusque dans les années 1990 pour prévenir les fausses couches, ce médicament a accru l’incidence de l’endométriose chez les filles exposées in utero.
Sensibiliser professionnels et grand public
L’endométriose est mal connue, donc mal diagnostiquée, mal recensée, et toujours mal comprise : un cercle vicieux vérifié à l’échelle mondiale.
Aujourd’hui encore, le délai de diagnostic de l’endométriose est estimé à sept, voire dix ans d’après les résultats préliminaires de la cohorte française CompareEndo, rassemblant près de 5000 patientes. Les acteurs du monde entier — médecins, associations, patientes-expertes — estiment que, pour éviter cette errance médicale et les erreurs de diagnostic répétées, les priorités sont la sensibilisation du grand public et, plus encore, la formation des prestataires de soins de santé, médecins (en formation comme en exercice) et paramédicaux. Car un mauvais dépistage est synonyme de mauvaises données épidémiologiques. Aujourd’hui, nous savons seulement que la prévalence de l’endométriose avoisine 10 % des femmes en âge de procréer. Mais cela reste une estimation grossière, une fourchette haute pour certains épidémiologistes, basses pour d’autres. Bien d’autres points d’interrogation demeurent, comme la proportion précise de cas graves et de femmes infertiles, ou encore la répartition géographique des cas. Autant de freins pour bien comprendre et caractériser la pathologie. À cet égard, tous les pays sont logés à la même enseigne. En cause, le manque de formation des professionnels et l’errance diagnostique qui en découle, mais aussi l’absence de registres nationaux recensant l’ensemble des cas diagnostiqués. Voilà l’ampleur de la tâche à accomplir.

La stratégie nationale française
En janvier dernier, le gouvernement français a lancé une stratégie nationale de lutte contre l’endométriose. La France devient ainsi le deuxième pays au monde, après l’Australie, à élever ce sujet au rang d’enjeu de santé publique. L’enveloppe budgétaire annoncée — 20 millions d’euros — a été saluée par les associations de patientes, qui y voient un début de reconnaissance. Car jusqu’à présent, la recherche, principalement supportée par les dons des patientes, souffrait de la quasi-absence de financements publics. Outre des programmes de recherche fondamentale et clinique, cette somme servira à créer une base de données alimentée par les six cohortes nationales existantes, un registre national étant trop coûteux à mettre en place.
Développer des outils diagnostiques
Pour un dépistage précoce, il faut identifier une signature biologique.
Perspective encore lointaine, quoique les méthodes diagnostiques évoluent. La recherche de marqueurs biologiques de l’endométriose est en pleine expansion, menée par de nombreuses start-up de biotechnologie. Les microARN constituent par exemple une piste prometteuse. Ces petits ARN non-codants régulent l’expression génique (c’est l’épigénétique) et peuvent être sur ou sous-représentés si l’on souffre d’endométriose. En février 2022, un test salivaire reposant sur ces marqueurs a d’ailleurs fait grand bruit : l’Endotest de la start-up lyonnaise Ziwig. Une étude jugée pertinente, mais encore très préliminaire, car la production de microARN dépend de la physiologie de chacun, et jusqu’à présent, les résultats obtenus n’ont jamais pu être reproduits dans un autre laboratoire. Les marqueurs génétiques, eux, sont stables. D’après les généticiens spécialistes de la maladie, on pourrait même imaginer un diagnostic reposant sur une puce à ADN, un outil génétique qui contiendrait toutes les régions de prédisposition à l’endométriose — à la condition de réussir à les identifier, ce qui serait très long, compliqué et onéreux. L’avenir du diagnostic résiderait plutôt dans une combinaison de marqueurs, à la fois génétiques et épigénétiques, voire protéiques : à maladie complexe, signature biologique complexe. En attendant ces outils de pointe, les chercheurs se tournent vers des algorithmes d’aide au diagnostic reposant sur l’intelligence artificielle, évitant ainsi le recours systématique à la chirurgie pour constater la présence de lésions. Le plus souvent, une bonne imagerie médicale et un interrogatoire suffisent. C’est la fin du « tout chirurgical », en soi déjà une véritable révolution diagnostique !
Vers de nouveaux traitements
De nombreuses pistes sont explorées pour mettre au point de nouveaux traitements, mais le processus restera long.
La prise en charge des patientes atteintes d’endométriose a beaucoup changé ces dernières années. Au lieu d’opérer systématiquement, les médecins font aujourd’hui du cas par cas et préservent la fertilité à tout prix, en ayant recours aux fécondations in vitro ou à la congélation d’ovocytes. Quant aux traitements, ils n’ont pour le moment qu’un effet suspensif, en bloquant le cycle menstruel, comme les pilules œstroprogestatives ou progestatives, prescrites en première intention. Une ablation complète des lésions reste le seul moyen actuel d’éliminer la maladie, même si elle n’empêche pas les récidives. Cela étant, de nombreux traitements innovants, non hormonaux, sont à l’étude à des stades encore très préliminaires, notamment des thérapies épigéniques (qui modifient l’expression des gènes). En 2018 et 2019, une équipe de l’école de médecine de Yale a identifié deux microARN prometteurs pour corriger l’expression de certains gènes de prédisposition à l’endométriose et constaté une amélioration de la maladie sur des modèles animaux. Des combinaisons de microARN sont aussi à l’étude. Autre piste, efficace chez les souris : agir sur l’immunité innée, en particulier le profil des macrophages (un type de globule blanc), pour faire régresser les lésions. Une chose semble assurée : on ne trouvera pas de pilule magique pour soigner l’endométriose, et les progrès seront progressifs, car notre biologie est d’une complexité forgée par 3,5 milliards d’années d’évolution.

Inhiber un gène clé
En 2021, une équipe de l’université d’Oxford s’est penchée sur un des nombreux variants génétiques associés au risque d’endométriose grave. Elle l’a d’abord identifié grâce à la comparaison des données génétiques de femmes et de familles présentant, ou non, de multiples cas d’endométriose : il s’agit du gène codant pour la protéine membranaire NPSR1. L’équipe a ensuite testé son inhibition sur des souris auxquelles des morceaux d’endomètre avaient été injectés pour simuler une endométriose. Résultat : l’inhibition de NPSR1 réduit l’inflammation et la douleur ressentie. Toutefois, dans le cas d’une maladie complexe et polygénique, un traitement agissant sur un seul gène ne serait sans doute efficace que dans une petite fraction des cas graves.