Comment la thérapie génique a transformé la vie de patients souffrant de drépanocytose
Publié le - par LeBlob.fr, avec l'AFP
Leurs histoires sont partagées entre un avant et un après. D'abord, de longues années de maladie, emplissant chaque moment de douleur. Puis, enfin, la vie sans drépanocytose. Deux Américains atteints de cette maladie du sang racontent leur parcours, après avoir bénéficié de traitements novateurs, quoique très lourds.
Leur espoir : faire connaître ces thérapies géniques tout juste autorisées par les autorités sanitaires américaines, afin que d'autres puissent y recourir. Mais leur coût exorbitant - jusqu'à 3,1 millions de dollars par personne - pourrait en limiter l'accès.
Préjugés
Tesha Samuels est née en 1982, juste avant le début des dépistages néonataux de la drépanocytose, une maladie génétique qui touche environ 100 000 personnes aux Etats-Unis et 20 millions dans le monde. Elle affecte surtout des personnes noires. Une raison, selon les scientifiques, est que le trait drépanocytaire protège du paludisme.
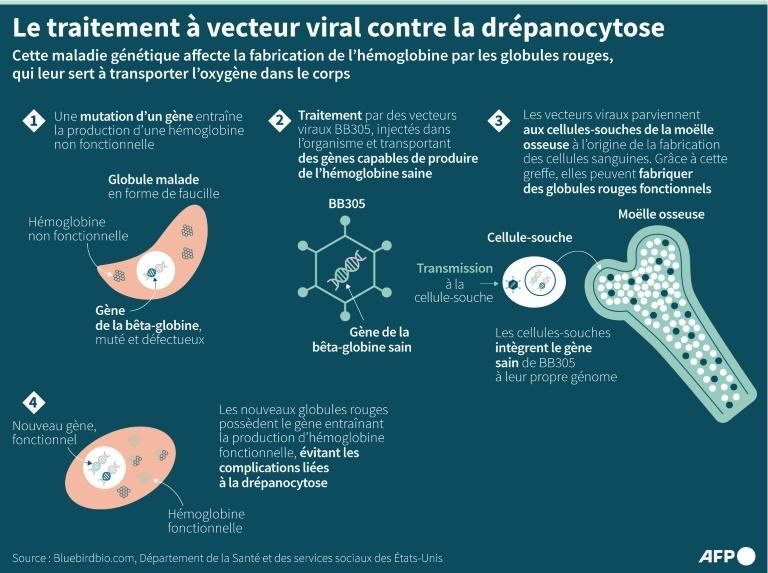
Les patients atteints de drépanocytose présentent une mutation qui affecte l'hémoglobine, une protéine des globules rouges transportant l'oxygène. Les globules rouges prennent alors une forme de faucille, restreignant la circulation sanguine et la délivrance d'oxygène.
Les conséquences possibles sont dramatiques : anémie, crises de douleur, dommages aux organes et mort prématurée.
Tesha Samuels a été diagnostiquée à deux ans. A sept, elle souffre d'une dangereuse crise d'anémie, et à 13 ans, un AVC la force à des transfusions sanguines mensuelles. Selon elle, les « préjugés sur les enfants noirs allant à l'hôpital pour dire qu'ils ont mal » l'ont fait attendre que les choses dégénèrent avant d'agir.
Jeune adulte, elle perd un ami, « un guerrier de la drépanocytose », qui se retrouvait souvent au même hôpital qu'elle. Elle étudie à la prestigieuse université Howard, espère devenir médecin, mais doit abandonner à cause de sa maladie. « Vous revenez sur vos rêves », raconte-t-elle. Jeune mariée, elle a besoin de huit heures de perfusions chaque nuit.
« Revenir à la vie »
En 2018, sa vie prend un nouveau tournant : elle devient l'une des premières à recevoir un traitement alors expérimental. Aujourd'hui commercialisé sous le nom de Lyfgenia, il utilise un virus inoffensif pour transporter dans les cellules une version saine du gène produisant l'hémoglobine.
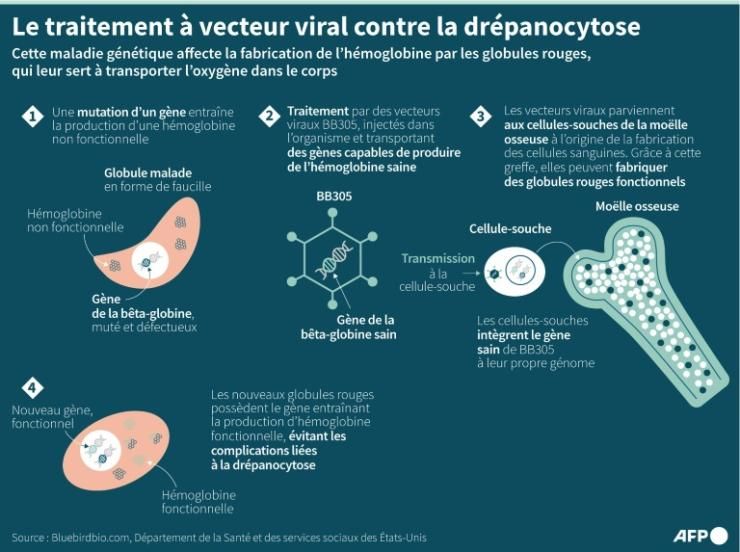
Les médecins prélèvent d'abord les cellules souches du patient. Puis vient la partie difficile : une chimiothérapie élimine les cellules souches de la moelle épinière du patient, pour faire la place aux cellules modifiées. Tesha Samuels perd ses cheveux, et est hospitalisée à cause d'un saignement du nez qui dure 16 heures. Ses plaquettes sanguines prennent des mois à revenir à la normale.
Puis, elle retrouve son énergie. « C'est comme revenir à la vie », raconte-t-elle. « Vous avez une nouvelle vie devant vous. Qu'en faire ? » Elle reprend ses études et obtient son diplôme. Et crée une organisation, « Journey to ExSCellence », pour faire connaître le traitement au sein de la population afro-américaine. Chaque patient ayant participé à l'essai clinique sera comme elle suivi pendant 15 ans.
Années de lutte
Jimi Olaghere, 38 ans, a un parcours similaire.
Son premier souvenir concernant sa maladie remonte à ses huit ans. Lorsqu'il joue au foot au Nigéria, son pays natal, il doit s'arrêter toutes les cinq minutes pour se reposer et boire. « Je demandais à ma mère, pourquoi je suis différent ? », se rappelle-t-il.
Ses parents l'envoient vivre avec une tante dans le New Jersey, aux Etats-Unis, où les soins de santé sont meilleurs, mais où son enfance reste une lutte. Il ne parvient pas à terminer ses études, doit subir une ablation de la vésicule biliaire, et fait une crise cardiaque. A la pire période, il passe 80% de son temps au lit.
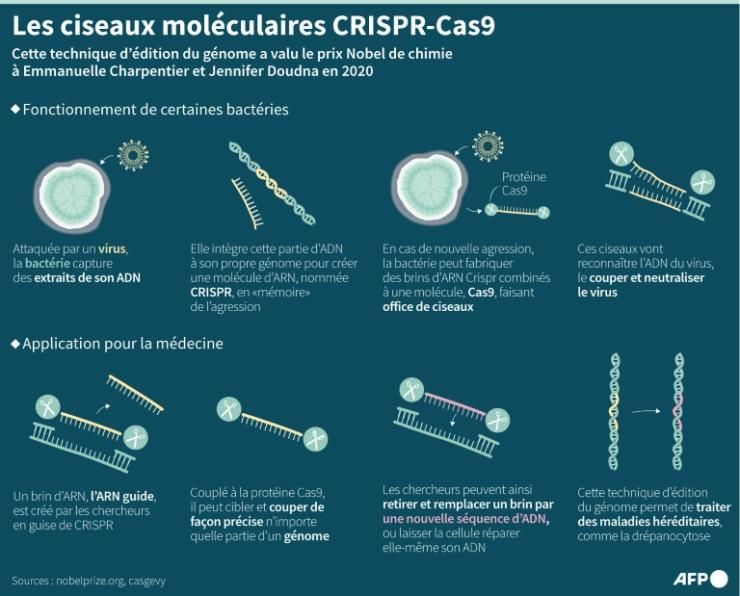
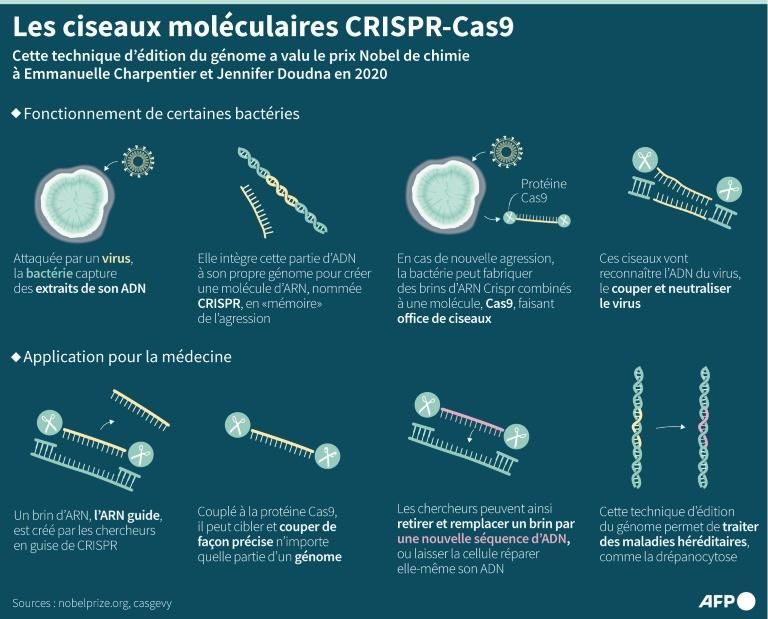
Déménager à Atlanta, où il fait plus chaud, l'aide, comme c'est le cas pour beaucoup de malades de la drépanocytose. Puis, en 2019, il entend parler d'un essai clinique utilisant les ciseaux moléculaires Crispr. Après s'être inscrit, il reçoit un message « magique » lui annonçant qu'il est accepté. Grâce aux cellules souches modifiées qu'il reçoit avec ce traitement, nommé Casgevy, Jimi Olaghere « vit désormais un rêve ».
Il a trois enfants, grâce à une fécondation in vitro (FIV), et gère plusieurs petits commerces. Lui aussi cherche à populariser ce traitement, notamment en Afrique, où son accès semble encore un rêve lointain.
Pour John Tisdale, des Instituts américains pour la santé (NIH), qui ont conduit l'essai auquel Tesha Samuels a participé, la prochaine étape est de rendre le traitement moins lourd pour les patients, et moins cher.
Une incertitude demeure sur la prise en charge de ces thérapies géniques par les assurances santé privées. Mais Medicaid, un programme public, a annoncé les couvrir à partir de l'année prochaine.