Prime editing : un nouvel outil d’édition du génome polyvalent et précis
Publié le - par Barbara Vignaux
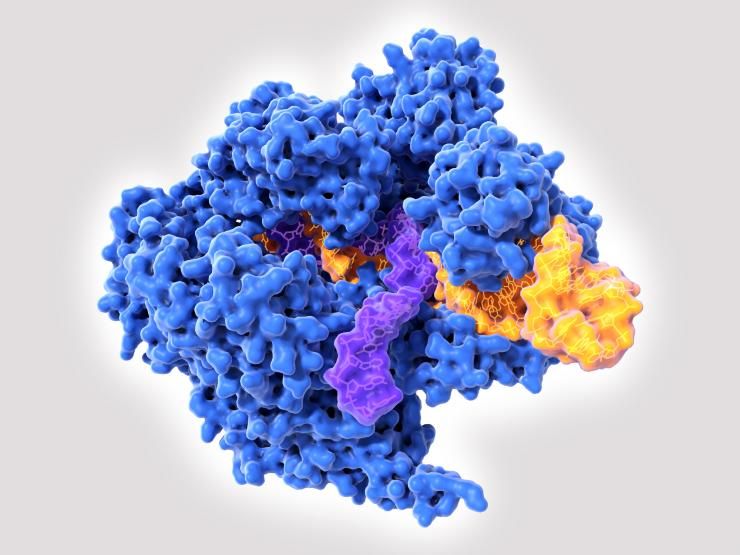
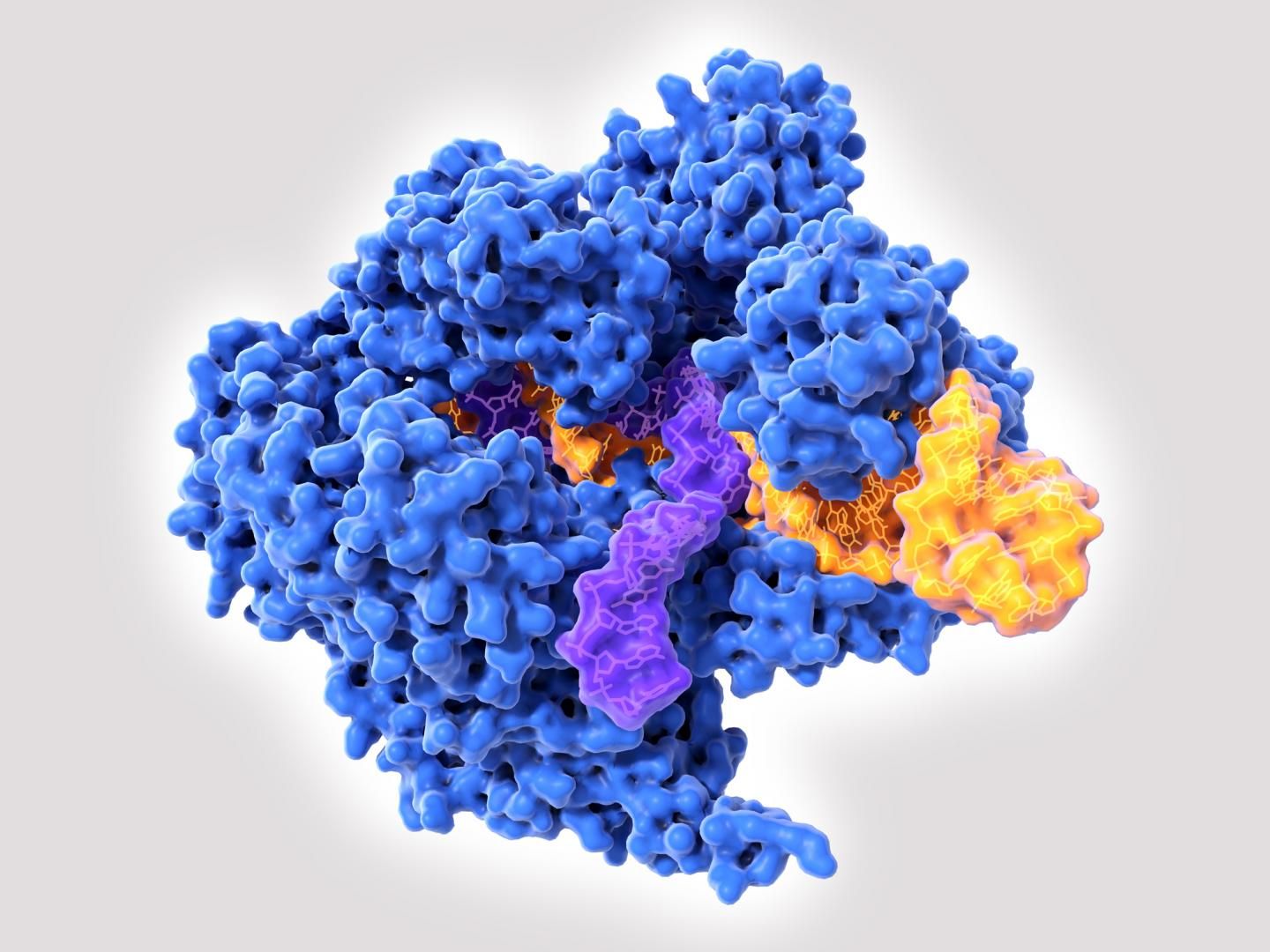
Après Crispr-Cas9, un nouvel outil de modification génétique, encore plus précis, vient d’être mis au point : l’édition primaire ou de base (prime editing). Son principal avantage est qu’il limite les effets secondaires liés à la manipulation. Car, même très précis, Crispr-Cas9 ne permet pas d’éviter totalement des altérations autres que celle voulue. En effet, Crispr-Cas9 casse les deux brins de la double hélice de l’ADN et compte sur la cellule pour réparer elle-même les dommages. Mais ce système de réparation n’est pas fiable et peut conduire à une insertion ou une suppression de lettres d’ADN à l’endroit de la coupure.
Cette incertitude sur les effets réels de Crispr-Cas9 rend son utilisation délicate. L’édition primaire rendrait, elle, les thérapies géniques plus sûres pour l’Homme. En effet, les enzymes qu’elle utilise n’ont pas besoin de briser les deux brins d’ADN pour apporter des changements : inutile donc de recourir à la réparation cellulaire de l’ADN, que les chercheurs ne peuvent contrôler.
En outre, cette technique, plus polyvalente, permettait une plus grande variété d’éditions du génome, et donc une application à un éventail plus large de maladies génétiques. Selon l’auteur principal de l’étude parue dans Nature le 21 octobre 2019, David Liu, biologiste chimiste au MIT et à Harvard (Cambridge, Massachusetts), le prime editing pourrait « réparer » près de 90 % des maladies liées à une mutation génétique pathogène. Les 175 modifications que son équipe a apportées à des cellules humaines in vitro – insertions, suppressions, mutations diverses – se sont déroulées de manière satisfaisantes et ont permis de « soigner » des maladies jusqu’ici considérées comme incurables.
La précision des modifications génomiques que ce nouvel outil est capable de réaliser facilitera aussi la mise au point de modèles de maladies en laboratoire ou l’étude de la fonction de gènes spécifiques, selon David Liu. « Ce ne sont que les premiers jours, mais les premiers résultats sont fantastiques, a confié à Nature Brittany Adamson, qui étudie la réparation de l’ADN et la modification génétique à l’université Princeton (New Jersey) : Vous allez voir beaucoup de gens l’utiliser ».
En revanche, le prime editing ne sera sans doute pas capable d’opérer de grandes insertions ou suppressions d’ADN, à l’instar de CrisprCas9. Par conséquent, estime le biologiste moléculaire Erik Sontheimer, de la faculté de médecine de l’université du Massachusetts à Worcester, « différents types de plates-formes d’édition de génomes seront encore nécessaires pour différents types d’éditions ».
En attendant, David Liu reste prudent : « Cette première étude n’est que le début – et pas la fin – de la réalisation d’une vieille aspiration dans les sciences de la vie : être capable d’effectuer n’importe quel changement d’ADN à n’importe quelle position dans un organisme ».