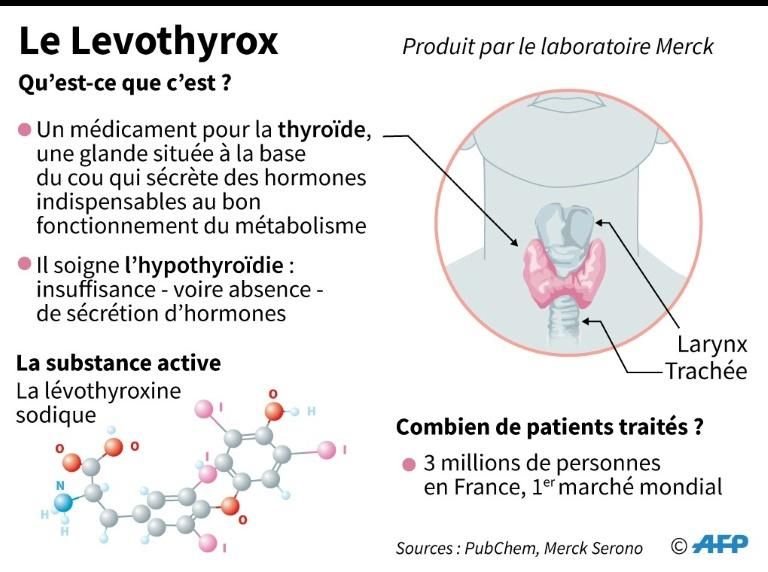
La fin de l’ancien Levothyrox annoncée pour septembre
Publié le - par le blob, l'extra-média, avec l'AFP
La fin de l’ancien Levothyrox a été repoussée à plusieurs reprises, mais cette fois semble être la bonne : cette version du médicament ne sera plus vendue en France à partir de septembre, après avoir été temporairement distribuée aux patients mécontents du changement de formule en 2017.
« Cela avait été reporté plusieurs fois, à fin 2018 puis à fin 2019, mais là, la date butoir semble bien actée », a réagi auprès de l’AFP Beate Bartès, de l’association de patients Vivre sans thyroïde, qui a désormais « assez peu d’espoir ».
L’annonce a été faite par le ministère de la Santé après la septième réunion du comité de suivi sur ce médicament pour la thyroïde, dont le changement de formule avait été accusé par des milliers de patients de provoquer des effets indésirables (maux de tête, insomnies, vertiges…). « Le laboratoire (Merck) producteur d’Euthyrox (nom sous lequel est vendue l’ancienne formule du Levothyrox, N.D.L.R.) a informé les autorités sanitaires de la fin de distribution de ce produit en France en septembre 2020 », a indiqué le ministère dans un communiqué.
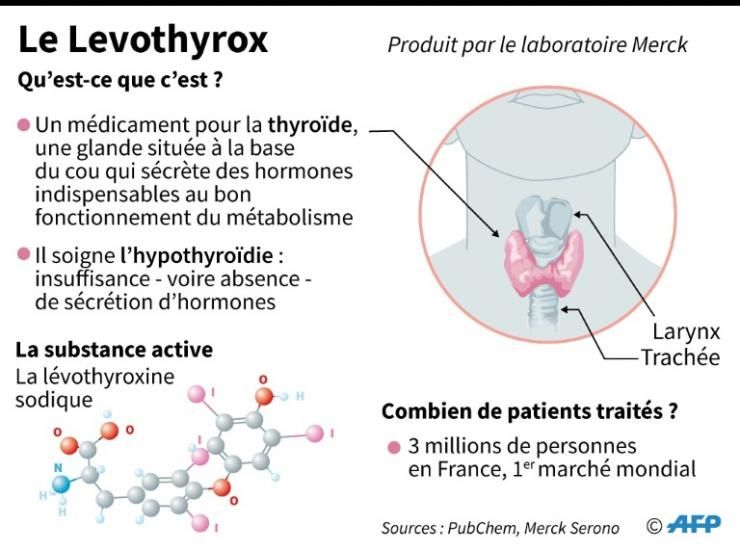
« La décision a été prise conjointement avec le ministère », a précisé à l’AFP Valérie Leto, pharmacien responsable de Merck France. Le laboratoire se dit incapable d’assurer l’approvisionnement au-delà : « C’est vraiment un arrêt définitif ». Selon le ministère, « plus de 110 000 patients sont traités par Euthyrox, soit 3,7 % des 3 millions de patients traités par lévothyroxine », la substance active de ce médicament pour la thyroïde. Mais selon Merck, ce chiffre, qui date du troisième trimestre 2019, est « obsolète » : « Selon les derniers chiffres en notre possession, environ 88 000 patients sont actuellement sous Euthyrox ». À l’inverse, Mme Bartès juge que ce nombre pourrait monter à 150 voire 200 000 patients, en comptant ceux qui s’approvisionnent à l’étranger.
La polémique autour du Levothyrox a éclaté en 2017 après le changement de formule, qui concernait certains des excipients du médicament (et pas la substance active). Son objectif, selon le laboratoire : renforcer la stabilité du produit.
Procès
Les protestations des patients mécontents ont poussé le gouvernement à demander fin 2017 l’importation de l’ancienne formule (sous le nom d’Euthyrox), ainsi que l’arrivée sur le marché de produits concurrents du Levothyrox, jusque-là en situation de quasi-monopole. Cinq sont disponibles à ce jour (L-thyroxin Henning, Thyrofix, L-thyroxine SERB, TCAPS et TSOLUDOSE, les deux derniers n’étant pas remboursés). Selon les chiffres officiels, le marché est dominé par la nouvelle formule du Levothyrox (76 % des patients), suivie du L-thyroxin Henning (19 %).
La liste des endroits où l’ancien Levothyrox est toujours disponible se réduit : en comptant la France, premier à avoir sauté le pas, quinze pays d’Europe sont aujourd’hui passés à la nouvelle formule, selon Merck. C’est pourquoi l’Euthyrox, précédemment importé d’Allemagne, l’a été de Russie fin 2019. « Merck produit plusieurs millions de boîtes d’Euthyrox dans le monde, pourquoi ne fournirait-il pas 120 000 patients français ? », a déclaré le Dr Philippe Sopena, conseiller scientifique d’une autre association de patients, l’AFMT (Association française des malades de la thyroïde). « À terme, il est prévu qu’au niveau mondial, l’ancienne formule soit remplacée par la nouvelle, en fonction des décisions et des autorisations que nous recevrons des autorités », a souligné Mme Leto.
Le ministère de la Santé publiera en février des recommandations destinées aux médecins, pharmaciens et patients « pour les accompagner dans tout changement » de traitement. Selon une étude menée sur plus de deux millions de patients, publiée en juin par l’Agence du médicament ANSM, le passage à la nouvelle formule du Levothyrox n’a pas engendré de « problèmes de santé graves ».
D’après les rapports de pharmacovigilance de l’ANSM, 31 000 signalements d’effets indésirables ont été déposés entre mars 2017 et avril 2018. Les associations assurent que davantage de malades sont concernés. L’affaire fait en outre l’objet de procédures judiciaires. Au pénal, elle est instruite par le pôle santé du tribunal de Marseille. Au civil, le procès en appel a eu lieu mardi à Lyon et la décision a été mise en délibéré au 9 avril. Ce procès oppose Merck à quelque 3 300 malades, qui l’accusent de les avoir mal informés lors du changement de formule. En première instance, les plaignants avaient été déboutés.